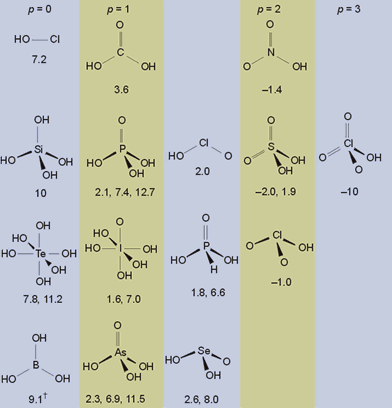
- Para un oxoácido OpE(OH)q, el valor del pKa es de aproximadamente 8-5p.
- Los valores de los pKa sucesivos en ácidos polipróticos (q>1) van aumentando de cinco en cinco unidades con cada pérdida de un protón.
Por ejemplo, el ácido sulfúrico, O2S(OH)2 tiene p =2 y q=2. Las reglas de Pauling predicen pKa1 = -2 y pKa2 = +3, que están en buen acuerdo con los valores experimentales de -2.0 y +1.9.
Definición de Lewis
En 1923, Lewis propuso una definición de ácido y base en función de la compartición de electrones. Esta es la definición más empleada hoy en día, sobre todo en las reacciones orgánicas. Un ácido es una sustancia capaz de aceptar un par de electrones y base es aquella sustancia capaz de donar un par de electrones. El par de electrones referido queda como compartido por ambas especies. Además de las reacciones que ya se han estudiado, esta definición engloba aquellas en las que no se forman iones, ni se transfieren protones. Por ejemplo,
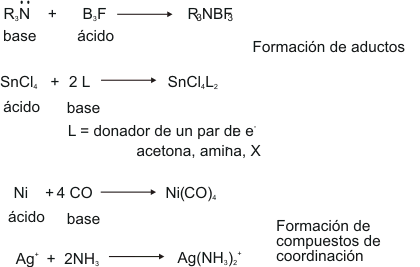
La reacción de ácido-base de tipo Lewis más simple es aquella que ocurre en fase gaseosa o en ausencia de moléculas de disolventes donadores, pues así no aparecen interferencias y los reactivos (el ácido y la base) sólo pueden interaccionar entre ellos. Es el caso, por ejemplo, del SO3 y el éter metílico, o del trifluoruro de boro con el amoniaco. En ambos casos se obtiene un nuevo compuesto en el que ácido y base se unen mediante un enlace covalente. Este enlace puede explicarse en función de los orbitales frontera del ácido y de la base. Así, el HOMO de la base se mezcla con el LUMO del ácido para dar dos orbitales moleculares, enlazante y antienlazante, de los que sólo se ocupa aquél. Esta descripción explica el hecho de que la gran mayoría de este tipo de reacciones sean exotérmicas, debido a la ganancia en estabilidad energética que se obtiene al ocuparse el orbital molecular enlazante.
Concepto General de Ácidos y Bases
Las definiciones anteriores se caracterizan por describir a un ácido como una sustancia que cede una especie positiva (protón o catión del disolvente) o acepta especies negativas (ion óxido o par de electrones) y una base como una sustancia que cede especies negativas (electrones, ion óxido, anión del disolvente) o aceptan especies positivas (protones).
Esas definiciones se pueden unificar especificando que la acidez consiste en el carácter positivo de una especie química, el cual disminuye al reaccionar con una base. La basicidad de una sustancia sería el carácter negativo de dicha especie, que disminuye al reaccionar con un ácido.
De esta manera se engloban todas las definiciones anteriores. Además resulta útil relacionar la fuerza como ácido o base con otros conceptos como la densidad electrónica o la estructura molecular. El concepto ácido-base no explica las propiedades de las sustancias (las cuales se explican mediante los principios de estructura y enlace), sino que tan sólo sirve para correlacionar los hechos experimentales observados.
Fuerza de Ácidos y Bases
Generalmente, los estudios de las propiedades ácido-base de las sustancias se llevan a cabo en disolución. Como quiera que la medición de la fuerza relativa de un ácido o de una base es fundamentalmente termodinámica, se ve influida por otros factores, como por ejemplo la solvatación (las Reglas de Pauling anteriormente mencionadas corresponden a disoluciones acuosas de oxoácidos). En los últimos años se ha desarrollado el estudio de las propiedades ácido-base en fase gaseosa, sin disolventes, con el fin de eliminar todos los efectos que puedan influir en la determinación de dicha acidez o basicidad.
Afinidad Protónica
La afinidad protónica proporciona la medida de la basicidad inherente a una especie química, y se define con relación a la energía que se libera en la siguiente reacción:
B(g) + H+ (g) ![]() BH+ (g)
BH+ (g)
ó
B- (g) + H+ (g) ![]() BH (g)
BH (g)
Estas reacciones son exotérmicas, ∆H<0, por lo que para tener una escala de afinidades protónicas positivas hay que definirla como Ap = -∆H. Obsérvese el paralelismo con la afinidad electrónica y la entalpía de la ganancia de un electrón. Cuanto mayor sea el valor de Ap más fuerte será la base.
La manera más fácil de obtener la afinidad protónica es mediante un ciclo de Born-Haber:
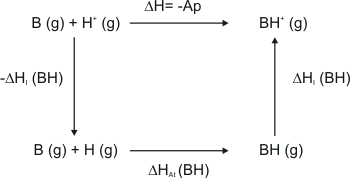
La especie BH debe ser lo suficiente estable como para poder determinar su ∆Hat. Entonces quedaría lo siguiente:
∆H = - Ap = -∆HI(H) - ∆HAt(BH) + ∆HI(BH)
Acidez en fase gaseosa
Como la Ap indica la tendencia que tiene una base a captar un protón, dicho valor equivaldrá a la entalpía de disociación de su ácido conjugado en fase gaseosa. Por ejemplo, Ap(F-) = 1554 kJ/mol
F- (g) + H+ (g) ![]() HF (g) ∆H = -1554 Kj/mol
HF (g) ∆H = -1554 Kj/mol
luego,
HF (g) ![]() HF- (g) + H+ (g) ∆H = 1554 Kj/mol
HF- (g) + H+ (g) ∆H = 1554 Kj/mol
Como ∆H>>0, el proceso es muy endotérmico, el HF es un ácido muy débil y estará poco disociado, y a su vez, su base conjugada, F-, es una base muy fuerte.
La afinidad protónica no se puede aplicar para estudiar la acidez de una ácido no prótico (Lewis). Si como se apuntó con anterioridad el electrón es la analogía básica del protón, la afinidad electrónica en fase gaseosa nos da la medida de la acidez, de manera análoga a como la afinidad protónica proporciona la medida de la basicidad. La AE es una medida de la facilidad o dificultad con la que la especie acepta electrones, es decir, es una medida de su acidez.
Ca2+ (g) + e-![]() Ca+ (g) AE = + 1145 KJ/mol
Ca+ (g) AE = + 1145 KJ/mol
K+ (g) + e-![]() K (g) AE = + 419 KJ/mol
K (g) AE = + 419 KJ/mol
ácidos de Lewis débiles
Mn2+ (g) + e-![]() Mn+ (g) AE = + 1509 KJ/mol
Mn+ (g) AE = + 1509 KJ/mol
Co3+ (g) + e-![]() Co2+ (g) AE = + 3232 KJ/mol
Co2+ (g) AE = + 3232 KJ/mol
ácidos de Lewis fuertes
De los datos anteriores puede inferirse que los iones de los metales de transición son más ácidos que los alcalinos y alcalinotérreos.