Se denomina calor específico a la capacidad calorífica correspondiente a la unidad de masa del sistema.
Así, denominamos m a la masa del sistema, cuya capacidad calorífica media es
![]()
Donde c es el calor específico medio, para el intervalo de temperatura ΔT. El calor específico es una propiedad intensiva, o sea independiente de la masa del sistema. Como su valor depende le la temperatura, lo mismo que la capacidad calorífica, para definirlo a una cierta temperatura debemos disminuir todo lo posible el intervalo ΔT haciendo tender las temperaturas al valor adoptado; o sea
![]()
Donde c es el calor específico verdadero a una temperatura T.
Unidades
Cuando la masa se expresa en gr, el calor específico correspondiente a la capacidad calorífica de 1 gr del sistema, siendo sus unidades: cal. gr –1 . grado–1; pudiendo expresarse también, evidentemente: kcal. Kgr–1. grado–1.
Cuando la masa se expresa en moles, es decir, en el número de pesos moleculares gr del sistema, el calor específico corresponde a la capacidad calorífica de 1 mol, de sistema y se lo denomina: “capacidad calorífica molar”, “calor molar” o directamente “calor específico molar”.
Sus unidades serán: cal. mol–1 . grado–1
Cuando la masa se expresa en átomos-gramo, la capacidad calorífica de 1 átomo-gramo se denomina “calor atómico” y se expresa en cal . at . gr–1 . grado–1.
Calor específico del agua
Como ya dijimos, el calor específico del agua varía con la temperatura.
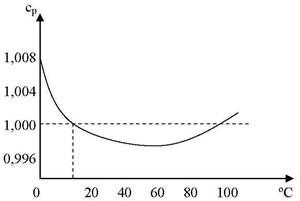
En la figura se ha representado la variación del calor específico del agua entre las temperaturas de 0 y 100 ºC, manteniendo la presión constante de 1 atmósfera.
Se puede observar que el valor es 1 en las proximidades de 15 ºC, debido a las forma escogida para definir la unidad de calor.