Estructura del benceno de Kekulé
A mediados del siglo XIX, se sabía que el benceno era insaturado, con una formula C6H6, la cual requería cuatro dobles enlaces, anillos o una combinación de ambas cosas. Además se sabía que no experimenta reacciones características de alquenos, como por ejemplo, cuando se le hace reaccionar lentamente con bromo en presencia de hierro, se formara un producto de sustitución C6H5Br, en vez del grupo C66H4Br2, que es el de adición, y no se producían otros isómeros distintos.
Basándose en estos resultados, Augus Kekulé propuso en 1865 que el benceno consiste en un anillo de carbonos y que puede formularse como un 1,3,5-ciclohexatrieno, y esto explicaba la formación de un solo sustituyente del monobromado.
El problema partía en el dibromado, ya que existían cuatro isómeros, dos 1,2-dibromociclohexatrieno, uno 1,3-dibromociclohexatrieno y uno 1,4-dibromociclohexatrieno. Esto lo explicó Kekulé diciendo que los dobles enlaces se mueven con gran rapidez, con lo cual los bromos no pueden separarse.
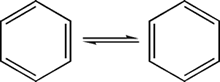
El movimiento de los enlaces ocurre velozmente.
Teoría de resonancia
Como Kekulé dijo el benceno presenta dos posibles estructuras equivalentes en la cual cada enlace carbono - carbono es en promedio 1,5 enlaces; el valor medio entre el doble y el sencillo.
A continuación se verá los cuatro postulados de la teoría de resonancia del benceno y de los hidrocarburos aromáticos:
- Las estructuras resonantes son imaginarias, no reales. La estructura del benceno es un híbrido que no cambia, único, en el que se combinan ambas formas de resonancia.
- Las estructuras resonantes difieren solo en las exposiciones de sus electrones. Ni la posición, ni la hibridación de los átomos cambia de una estructura de resonancia a otra. En el benceno los seis núcleos de carbono forman un hexágono regular, mientras que los electrones Pi son compartidos por igual entre los núcleos vecinos, cada enlace carbono - carbono tiene un promedio de 1,5 electrones, y todos los enlaces son equivalentes.
- Las distintas formas de resonancia no tienen que ser equivalentes. Sin embargo mientras más equivalentes sean las formas, tanto más estable será la molécula. Así el benceno con dos formas de resonancia equivalentes, es muy estable.
- Tanto más estructuras de resonancia haya, tanto más estable será la molécula.
(Química Orgánica McMurray, Paginas 508-509).
Se puede concluir, entonces, que la estructura del benceno es única y no oscila entre dos estructuras de Kekulé; pero por convención se dice que el benceno toma una de las estructuras resonantes, para mayor facilidad de trabajo con su estructura en forma escrita. Cabe destacar que cualquiera de las estructuras de Kekulé que se tomen serán en consecuencia equivalentes.
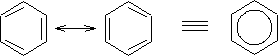
Estabilidad del benceno
El benceno no representa el comportamiento característico de los alquenos. Por ejemplo no reacciona con permanganato de potasio para formar productos de ruptura, ni con ácido acuoso para generar alcoholes y tampoco con HCl gaseoso para producir halogenuros de alquilo. Además no experimente reacciones de adición electrofílica.
Se puede tener una idea de la estabilidad del benceno examinando los calores de hidrogenación. El ciclo hexeno tiene una variación de 28 Kcal/mol; el 1,3-ciclo hexadieno, alcanza una variación de 55,4 Kcal/mol, Se puede desprender de esto que el valor para el segundo es poco menos del doble del valor que para el primero.
Continuando con la analogía, se advierte que para el ciclo hexatrieno(benceno), debiera ser de tres veces el valor del ciclo hexeno, 86 kcal/mol. El valor real para el ciclo hexatrieno es de 49,8 kcal/mol, casi 36 Kcal/mol de estabilidad extra.
Otra prueba de la estabilidad poco usual del benceno se debe a la longitud de sus enlaces. Los enlaces sencillos carbono - carbono, tienen una longitud de 1,54 Aº , y los de los dobles normales, es de 1,34 Aº , en el benceno la longitud de enlace es de 1,39 Aº.
Aromaticidad y regla 4n + 2 de Hückel
Según el científico Alemán Erich Hückel, una molécula será aromática si tiene un sistema monociclo planar, con un orbital P en cada átomo y solo si el sistema de orbitales P contiene 4n + 2 electrones Pi donde n es un numero entero (0,1,2,3,4...), es decir las moléculas que contienen 2,6,14,18,... Electrones Pi pueden ser aromáticas. Las moléculas que contienen 4n electrones Pi (4,8,12,16...) no pueden ser aromáticas aunque sean cíclicas y conjugadas.
Naftaleno y policiclos aromáticos
Aunque la regla de Hückel se aplica solo a los compuestos aromáticos monociclos; el concepto de aromaticidad puede extenderse más allá formando los llamados compuestos aromáticos policíclicos. El más simple de estos es el Naftaleno, con dos anillos bencenoides unidos lado a lado. Posee tres estructuras de Kekulé, es decir, tres formas de resonancia. Así como el benceno es una forma intermedia entre sus fases de resonancia, el naftaleno y todos los compuestos aromáticos policíclicos también son un punto intermedio entre sus fases de resonancia.
Entre los compuestos aromáticos policíclicos se encuentran: el Naftaleno, Antraceno, Fenantreno, Benzo(a)pireno, Coroneno, etc.