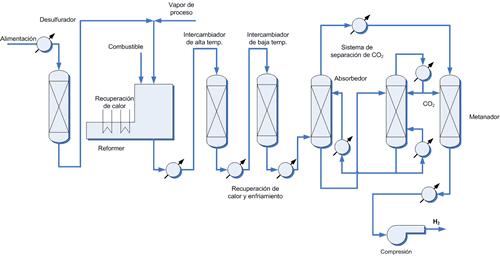
Proceso productivo del hidrógeno
Actualmente se utiliza el siguiente proceso por etapas:
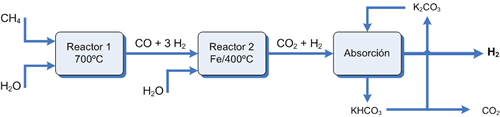
(1) Reacción endotérmica catalizada entre el metano (gas natural) con vapor de agua a alta temperatura (steam reforming) produciendo una mezcla de monóxido e H. llamada syngas o gas de síntesis. La mezcla gaseosa así obtenida es difícil de separar ya sea física o químicamente (es necesario enfriar hasta -205 ºC antes de que el monóxido pueda condensar)
CH4 (g) + H2O (g) (Ni, 800ºC) ![]() CO (g) + 3H2 (g) ΔH = +206 KJ
CO (g) + 3H2 (g) ΔH = +206 KJ
(2) Para aumentar el rendimiento y facilitar también la separación posterior, el monóxido se oxida a dióxido. Para ello, la mezcla es enfriada y se le inyecta vapor de agua de nuevo, esta vez sobre un catalizador de oxido de hierro III (Fe2O3).
CO (g) + H2O (g) (Fe2O3, 400ºC) ![]() CO2 (g) + H2 (g) ΔH = -41.2 KJ
CO2 (g) + H2 (g) ΔH = -41.2 KJ
Así pues la reacción global será:
CH4 (g) + H2O (g) ![]() CO2 (g) + 4H2 (g) ΔH = +164.8 KJ
CO2 (g) + 4H2 (g) ΔH = +164.8 KJ
El problema de separar el dióxido del H. es más sencillo. Hay varias formas de abordar la separación:
(1) Medios físicos Una opción es enfriar la mezcla por debajo de la temperatura de condensación del CO2 (-78 ºC) muy diferente a la del H2 (-253 ºC). Económicamente viable mediante un servicio de frío en planta.
(2) Medios químicos El CO2 es un oxido ácido que reacciona con una disolución de carbonato potásico para dar el carbonato ácido de potasio. Calentando este se puede regenerar el carbonato:
K2CO3 (ac) + CO2 (g) + H2O (l) ![]() 2KHCO3 (ac)
2KHCO3 (ac)
Una alternativa al metano es la utilización de cualquier otro hidrocarburo o incluso carbón (mas abundante pero mas costoso de transportar, se debe almacenar).
C (s) + H2O (g) (1000ºC) ![]() CO (g) + H2 (g) ΔH = +130 KJ
CO (g) + H2 (g) ΔH = +130 KJ
CO (g) + H2O (g) ![]() CO2 (g) + H2 (g) ΔH = -41.2 KJ
CO2 (g) + H2 (g) ΔH = -41.2 KJ
C (s) + H2O (g) ![]() 2H2 (g) + CO2 (g) ΔH = +88.7 KJ
2H2 (g) + CO2 (g) ΔH = +88.7 KJ
Como comparativa del steam reforming (con gas natural o hidrocarburos) y la oxidación parcial del carbón presento la siguiente tabla, muy genérica pero que contextualiza muy bien los dos métodos actuales de producción industrial de hidrogeno.
|
Hidrocarburos
|
Carbón |
|---|---|---|
| Temperatura | 1100-1500 ºC |
|
| Presión | 1 – 130 atm |
|
| Capacidad | 800e6 Nm3/año 7.7e6 GJ/año |
876e6
Nm3/año 8.4e6 GJ/año |
| Coste inversión | 186 millones U$S |
240-270 M U$S |
| Coste producción | 7.1-17 U$S/GJ |
10-17 U$S/GJ |
| Eficiencia | 75-86 % |
45- 50 % |
PRINCIPIOS QUIMICOS
De todos los procesos posibles de producción los más comunes son los descritos a nivel de formulación en el apartado anterior, que son el reformado de hidrocarburos con vapor y la oxidación parcial. El primero lo modelizare en el preproyecto, al ser de mayor aplicación en la industria pues el uso del gas natural tiene mayores ventajas que el uso del carbón (combustión sin cenizas, se transporta por gasoducto, economía de la materia prima, y otras consideraciones). Así pues aquí profundizare sobre otros métodos (proceso de gasificación de carbón y crackeo de amonio) y procesos no menos importantes de purificación a través de MEA (monoetanolamina), carbonato potásico caliente, solventes fluorados para dióxidos de carbono y purificación absorbente para otras impurezas presentes como monóxido, agua, metano, etano, Ar y Nitrógeno.
Procesos de oxidación parcial
A pesar de que estos procesos pueden funcionar perfectamente con gas natural, gas de refinería o otras mezclas de gases hidrocarbonatos su gran ventaja es que pueden producir hidrogeno a partir de hidrocarburos líquidos como gas oil, diesel, y en ocasiones fuel oil. Estas son tres versiones comerciales del proceso. (Texaco fueron los pioneros seguidos de Shell y Montecatini). Se emplea la combustión parcial no catalítica de la alimentación del
hidrocarbono con oxigeno en presencia de vapor en una cámara de combustión con temperaturas de llama que oscilan entre los 1300 y 1500 ºC.
La reacción global es exotérmica así que por encima de todo es un proceso que genera calor. La composición gaseosa del producto depende de la proporción C/H alimentada y del vapor amaleado, así pues la presión no tiene efecto significativo sobre esta composición. El proceso es habitualmente conducido de 2 a 4 MPa usando equipos compactos que reducen costes de compresión. Una composición típica en la salida para una alimentación de fuel oil es la mostrada en el cuadro.
Producto |
Fracción molar |
|---|---|
H2 |
0.48 |
CO |
0.461 |
CO2 |
0.043 |
CH4 |
0.004 |
N2, inertes |
0.003 |
H2S |
0.009 |
Total = 1 |
Este gas tiene una relación óxidos de carbón/hidrogeno mucho mas alta que el reformado con vapor.
En la aplicación comercial del proceso Texaco, el oil precalentado es mezclado a presión con oxigeno y vapor precalentados también para alimentar el quemador de oxidación parcial. Para obtener una producción de 100 metros cúbicos de hidrogeno y monóxido de carbono se emplean 26 metros de oxigeno al 95 – 99%. La mezcla producto es enfriada directamente en contacto con agua y filtrada de tal forma que se elimina del flujo gas el carbono no reaccionado. A su vez estos restos de carbono se eliminan del agua por filtración para un posterior uso o simplemente se desecha dicha agua (waste). El resto de etapas del proceso son las mismas que en el proceso de reformado: Shift de alta temperatura (mezcla con vapor y mezcla fluidizada a través de oxido de hierro, catalizador, para convertir el monóxido en dióxido, 90 a 95% de conversión), enfriado de nuevo antes de entrar en el Shift de baja temperatura. Enfriado a 38 ºC con agua antes de entrar al absorbedor de CO2 (usa MEA). Los gases purificados, no en su totalidad o aceptable al menos, se recalientan con los producidos en etapas anteriores antes de pasar al metanador que con Ni catalítico convertirá los gases carbónicos en metano. Este podría ser ya el producto final según especificaciones.
Procesos de gasificación de carbón
Hace una década se barajaba la posibilidad de que la producción de H. tomaría un peso mayor usando el carbón como materia de la que arrancaría el proceso, según se fueran agotando los yacimientos de gases hidrocarbonatos. Actualmente esta posibilidad aun queda un tanto lejana, pero la mayoría de líneas de inversión de las empresas apuestan por el uso del gas natural. Son pocas las que a su vez investigan fuentes alternativas de producción sin tener que emplear necesariamente el carbón. Así pues en los próximos años, y con un uso masivo del gas natural (y a su vez otras fracciones) puede agotar definitivamente dichos yacimientos. Será el momento de apostar por el metanol procedente de biomasa (países del hemisferio norte) y presumiblemente carbón (países hemisferio sur). En cualquier caso cierta controversia envuelve el uso de esta técnica.
El carbón fue empleado en las plantas más tempranas de producción de la mezcla COH2, estas plantas no pueden competir con los procesos modernos. Los gases producidos requieren una conversión shift de agua y gas y una subsiguiente purificación para producir H. de alta pureza. Así pues estas plantas son grandes y a su vez generan los invernaderos (al igual que las actuales térmicas a carbón, para hacer una burda comparativa).
Producción de H. a partir de crackeo de Amoniaco.
Crackeando (ruptura de enlaces por calor en ausencia de oxigeno) amoniaco obtenemos (según estequiometría molecular) una relación de volúmenes N2/H2 de 1:3. La mezcla resultante puede ser usada para hidrogenación pues el nitrógeno contenido es un inerte.
El proceso consiste en vaporizar el amoniaco desde unos cilindros, calentándolo a 870 ºC, haciéndolo pasar sobre un catalizador activado para mas tarde enfriarlo en un intercambiador de calor que extraerá energía para cedérsela al gas entrante al proceso.
Un único cilindro de 68 Kg. de anhídrido amónico puede producir 190 metros cúbicos de mezcla N2:H2.