El cloro se prepara raramente en el laboratorio debido a que se comercializa en botellas de presión de distintas capacidades. Se puede preparar, sin embargo, a pequeña escala mediante la adición lenta de HCl concentrado y desoxigenado sobre dióxido de manganeso hidratado. El Cl2 así generado se puede purificar pasándoloa través de agua, eliminándose el HCl, y de H2SO4, para eliminar el H2O. Por último se puede purificar más pasándolo por un tubo que contiene CaO o P2O5.
MnO2 (s) + 4HCl(conc.) → Cl2(g) + MnCl2(ac) + H2O(l)
La producción industrial de Cl2 se lleva a cabo mediante la electrólisis de disoluciones de NaCl: Las sales de NaCl empleadas suelen llevar impurezas que deben ser eliminadas antes de efectuar la electrolisis, en particular los iones Ca2+, Mg2+ y SO42-.
Mg2+ + Ca(OH)2 → Mg(OH)2¯ + Ca2+
Ca2+ + Na2CO3 → CaCO3¯ + 2 Na+
SO42- → Na2SO4 (tras concentrar)
La extracción de la sal bruta se obtiene mediante evaporación de las salinas por el sol. Esta evaporación tiene lugar en varios pasos: concentración del agua salada del mar en estanques; transporte del concentrado a otro estanque de evaporación donde se precipita el CaSO4, y finalmente en otro estanque de evaporación se realiza la cristalización del NaCl. Esta sal todavía tiene un alto contenido en magnesio y potasio, por lo que se debe llevar a cabo el lavado de la sal en unidades especiales donde se alcanza un contenido de NaCl en la sal de > 99%. De 1m3 de agua salada se obtienen 23 kg de NaCl. Dependiendo del tipo de proceso electrolítico utilizado se realizan posteriores purificaciones.
Existen tres tipos de procesos para producir Cl2: el del mercurio, el de membrana y el de diafragma.
Proceso del Mercurio
Este proceso utiliza disoluciones concentradas del NaCl (salmuera). La celda de amalgama está constituida por un contenedor de acero alargado e inclinado por debajo del cual fluye una capa de mercurio que actúa de cátodo y absorbe el Na que se produce en la reacción:
NaCl → Na + ½ Cl2
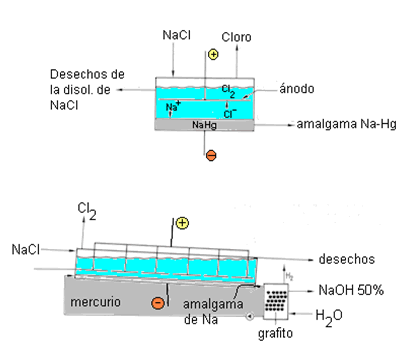
Figura 3. El proceso del mercurio
El cloro se produce en el ánodo que se puede ajustar en altura. La amalgama de Na que se obtiene se transfiere a un reactor donde se descompone, mediante hidrólisis con H2O, en Hg, NaOH (50%) e H2.
Na(Hg) + H2O → NaOH + H2 + Hg
Durante la electrólisis se dan las siguientes reacciones:
Reacción en el ánodo: Cl¯ → ½Cl2 +1e¯.............................Eº = 1.24 V
Reacción en el cátodo: xHg + Na+ + 1e¯ → NaHgx...........Eº = -1.66 V
Reacciones colaterales:
Cl2 + NaOH → NaOCl + NaCl + H2O (ánodo)
Cl2 +2e¯ → 2Cl¯ (cátodo)
ClO¯ + 2H+ + 2e¯ → H2O + Cl¯ (cátodo)
El rendimiento del proceso es del 94-97%. Una planta a gran escala produce de 50 a 300x103 ton del Cl2/año y de 56 a 340x103 ton de NaOH/año.
Datos de la Celda
- Área del cátodo: 10 a 30 m2
- Espesor de la capa de Hg: 3 mm
- [Na]Hg: 0.2 a 0.4% en peso
- 50-180 ánodos por celda
- Separación cátodo-ánodo: 3 mm
- Ánodo: grafito o Ti recubierto por metales del grupo del Pt.
- Sal procesada: 2 a 20 m3/h
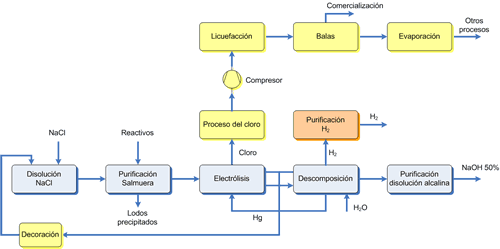
Figura 4. Diagrama de flujo del proceso de mercurio.
Proceso de Diafragma
En este proceso se emplean disoluciones acuosas de NaCl. Las celdas industriales de diafragma consisten en un depósito en el cual los ánodos se montan verticalmente y paralelos unos a otros. Los cátodos se sitúan entre los ánodos, son planos y de acero, recubiertos por fibras de asbesto impregnados con resinas flúor-orgánicas.
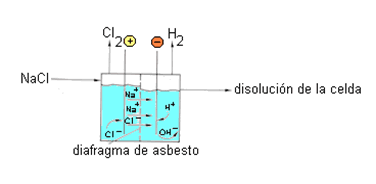
Figura 5. Celda del proceso de diafragma.
La disolución salina entra en la celda, pasa a través del diafragma de asbesto y entra en la cámara catódica. El Cl2 que se produce en el ánodo sale por la parte superior mientras que el H2, NaOH y NaCl residual se producen en el cátodo y salen de la celda por el lateral. El diafragma de asbestos cumple dos funciones:
a) Evitar la mezcla de H2 y Cl2.La estructura tan fina del material permite el paso de líquidos a través del mismo, pero impide el paso de las burbujas de gas. Un 4% del cloro (disuelto en la disolución) sí pasa a través del diafragma y se pierde en reacciones colaterales, disminuyendo el rendimiento
b) Impedir la difusión de los iones OH¯ formados del cátodo al ánodo.
La disolución que sale de la celda contiene un 12% de NaOH y un 15% de NaCl (en peso). La capacidad de una planta puede ser de hasta 360x103 ton de Cl2/año, y de hasta 410x103 ton de NaOH/año. Estas plantas consumen un 20% menos de energía que las plantas basadas en celdas de mercurio.
Proceso de Membrana
En este proceso el cátodo y el ánodo se encuentran separados por una membrana conductora iónica que es impermeable al agua, pero es permeable al paso de iones. El desarrollo de membranas que son estables bajo las condiciones de electrólisis (altas concentraciones de sales, alto pH, presencia de oxidantes fuertes como el Cl2 y el ClO¯-) ha supuesto muchos problemas. Un gran número de compañías como Du Pont, Asahi Chemical, Asahi Glass, entre otras, han conseguido preparar membranas consistentes en un esqueleto de poli(perfluoroetano) con cadenas laterales que contienen grupos polares (sulfatos, carboxilatos).
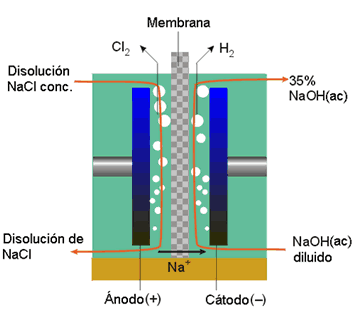
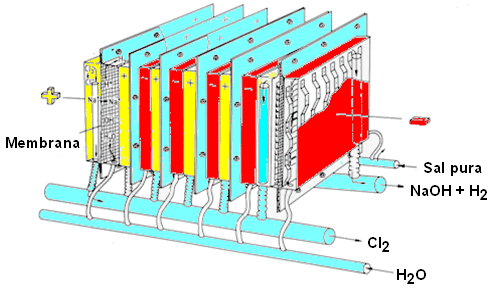
Los procesos que se producen en el cátodo o en el ánodo son los mismos que los que se dan en el proceso de diafragma. Se emplean ánodos de Ti activado y cátodos de acero inoxidable o de Ni. En este proceso la sal debe ser más pura que en el proceso de diafragma.
Comparación de los tres métodos:
Proceso del Mercurio |
Proceso de Diafragma |
Proceso de Membrana |
|
|---|---|---|---|
| Ventajas | -NaOH 50%-Cl2 puro | -utiliza sales menos puras-Utiliza menos energía que el proceso de mercurio. | -NaOH puro (20-25 %)-Consume sólo el 77% de la energía que se consume en el proceso de Hg-No utiliza Hg o asbestos |
| Desventajas | -Hg tóxico-Más energía consumida (más del 10-15% que el proceso de diafragma) | -NaOH de pureza media-El Cl2 contiene O2-Los asbestos son tóxicos | -el Cl2 contiene O2 -Se necesita sal de alta pureza.-Alto coste de las Membranas |
Aplicaciones del Cl2
Las tres aplicaciones más importantes del cloro son:
a) Producción de compuestos orgánicos clorados como clorometano, cloroetano, etc, y sobre todo el cloruro de vinilo, monómero del PVC. El 70% de la producción del Cl2 se emplea con este fin.
FeCl3 |
||
CH2=CH2 + Cl2 |
CH2ClCH2Cl |
450-500 ºC |
||
CH2ClCH2Cl |
CH2=CH2Cl + HCl |
b) Como blanqueante en las industrias del papel y textil; para la desinfección sanitaria de aguas, piscinas y en el tratamiento de aguas residuales. El 20% de la producción del Cl2 se emplea para este uso.
c) En la fabricación con compuestos inorgánicos como el HCl, Cl2O, HClO, NaClO3, PCl3, PCl5, etc. El 10% de la producción del Cl2 se emplea en esta síntesis de productos inorgánicos.