En esta sección se consideran los modelos de enlace que explican algunas características claves de los complejos: cómo se forman los enlaces metal-ligando, por qué prefieren ciertas geometrías, y por qué estos compuestos tienen colores tan brillantes y con frecuencia son paramagnéticos. Como se vio en los enlaces covalentes de otros compuestos, a menudo se requiere más de un modelo para contar la historia completa.
Aplicación de la teoría del enlace de valencia a complejos
La teoría del enlace de valencia (TEV), que se empleó para explicar el enlace y la estructura en compuestos de los grupos principales, también se usa para describir el enlace en los iones complejos. En la formación de los iones complejos, los orbitales llenos de los ligandos solapan con los orbitales d vacíos del ion metálico. El ligando (base de Lewis) dona un par de electrones, y el ion metálico (ácido de Lewis) lo acepta para formar uno de los enlaces covalentes del ion complejo (aducto de Lewis) Tal enlace, en el cual un átomo del enlace contribuye con ambos electrones, se llama enlace covalente coordinado, aunque, una vez formado, es idéntico a cualquier enlace covalente sencillo. Recuerda que el concepto de la TEV propone la mezcla de orbitales s, p y d para dar un conjunto de orbitales híbridos, los cuales tienen geometrías específicas. De manera parecida, para los compuestos de coordinación, el modelo propone que el número y tipo de orbitales híbridos del ion metálico ocupados por los pares de electrones cedidos por los ligandos determina la geometría del ion complejo. Discutamos las combinaciones de orbitales que llevan a los complejos octaédrico, plano-cuadrado y tetraédrico.
Complejos octaédricos
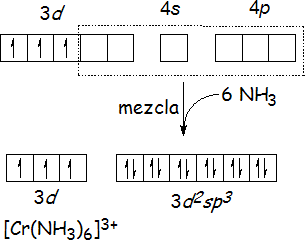
El ion [Cr(NH3)6]3+, ilustra la aplicación de la TEV a un complejo octaédrico. Los seis orbitales vacíos de menor energía del ion Cr3+ -dos 3d, uno 4s y tres 4p- se mezclan y convierten en seis orbitales híbridos equivalentes d2sp3 que apuntan hacia los vértices de un octaedro. Seis moléculas de NH3 donan los pares libres de electrones de los nitrógenos para formar seis enlaces metal-ligando. Los tres electrones despareados 3d del ion central Cr3+ ([Ar]3d3), que hacen que el ion complejo sea paramagnético, permanecen en orbitales sin hibridar.
Complejos plano-cuadrados
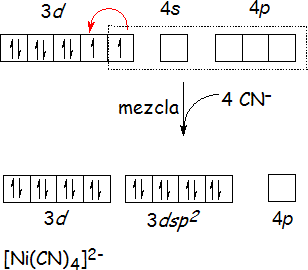
Los iones metálicos con una configuración d8 generalmente forman complejos plano-cuadrados. En el ion [Ni(CN)4]2- por ejemplo, el modelo propone que un orbital 3d, uno 4s y dos 4p del Ni2+ se mezclan y forman cuatro orbitales híbridos dsp2, los cuales apuntan a los vértices de un cuadrado y aceptan un par de electrones de cada uno de los cuatro ligandos CN-. Sin embargo, una mirada a la configuración electrónica en el estado fundamental del Ni2+ ([Ar]3d8) plantea una pregunta clave: ¿cómo puede el ion Ni2+ ofrecer un orbital vacío 3d si hay ocho electrones distribuidos en tres orbitales llenos y dos parcialmente llenos? Aparentemente, en la configuración d8 de Ni2+, los electrones en los orbitales parcialmente llenos se aparean, dejando un orbital 3d vacío. Esta explicación es consistente con el hecho de que el complejo es diamagnético (sin electrones desapareados) Además, se requiere que la energía que se gana al usar un orbital 3d para la formación de los orbitales híbridos, sea mayor que la energía requerida para vencer las repulsiones generadas al aparear a los electrones 3d.
Complejos tetraédricos
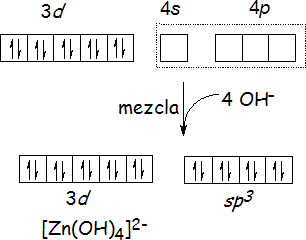
Los iones metálicos con un subnivel d lleno, como Zn2+ ([Ar]d10), forman a menudo complejos tetraédricos. Por ejemplo, en el complejo [Zn(OH)4]2-, la TEV propone que los orbitales más bajos disponibles del Zn2+ -uno 4s y tres 4p- se mezclan para convertirse en cuatro orbitales híbridos sp3 que apuntan hacia los vértices de un tetraedro y están ocupados por un par libre de cada uno de los cuatro ligandos OH-.
Teoría del campo cristalino
El tratamiento de la TEV es fácil de representar y racionaliza el enlace y la forma, pero trata a los orbitales como algo más que espacios vacíos que aceptan pares de electrones. En consecuencia, no revela nada acerca de los colores de los compuestos de coordinación y algunas veces predice de manera incorrecta sus propiedades magnéticas. En contraste, la teoría del campo del cristal proporciona poca información sobre el enlace metal-ligando, pero explica claramente los colores y el magnetismo. Para hacerlo, resalta los efectos sobre las energías de los orbitales d del ion metálico a medida que los ligandos se aproximan.
El modelo del campo del cristal, formulado por Bette y van Vleck en 1929, explica que las propiedades de los complejos resultan de la separación de las energías de los orbitales d debido a interacciones de tipo electrostáticas entre iones metálicos y los ligandos. El modelo asume que un ion complejo se forma como resultado de atracciones electrostáticas entre el catión metálico y la carga negativa de los ligandos. Esta carga negativa es parcial en un ligando polar neutro como el amoniaco o completa como en un ligando aniónico como el Cl-. Los ligandos se aproximan al ion metálico a lo largo de los ejes x, y y z, lo cual minimiza la energía total del sistema.
Considérese, en primer lugar, el caso de un complejo octaédrico. Los seis ligandos se consideran cargas puntuales que se sitúan en los ejes cartesianos cuyo origen es el ion metálico. Pero para llegar a esta situación final en la T.C.C. se consideran situaciones previas a ella. En principio, los cinco orbitales d del átomo metálico, en estado gaseoso y libre, tienen la misma energía (son degenerados). Si los ligandos se aproximaran al ion metálico creando un campo de simetría esférica los cinco orbitales d interaccionarían por igual con los ligandos aumentando la energía de los mismos por igual. Pero al concentrar al considerar a los ligandos como cargas puntuales en un campo de simetría octaédrica la situación cambia. Los electrones de los orbitales d del metal que apuntan directamente hacia los ejes de coordenadas x, y, z (donde están los ligandos), esto es, los orbitales dx2-y2 y dz2 son repelidos más intensamente por las cargas negativas de los ligandos que los electrones de los orbitales dxy, dxz y dyz, dirigidos entre los ligandos. En consecuencia, la energía de los orbitales dx2-y2y dz2 aumentará (como consecuencia de la fuerte interacción con los ligandos) y la de los orbitales dxy, dxz y dyz disminuirá respecto a la energía de los orbitales d en un campo de simetría esférica. Es decir, en un campo de simetría octaédrica los cinco orbitales d del metal pierden parcialmente la degeneración originando 2 series degeneradas: una de mayor energía, eg, doblemente degenerada y otra de menor energía, t2g, triplemente degenerada. La separación o diferencia de energía entre las series de orbitales eg y t2g se denomina parámetro de desdoblamiento del campo de los ligandos, DO (el subíndice o indica que el campo es octaédrico).
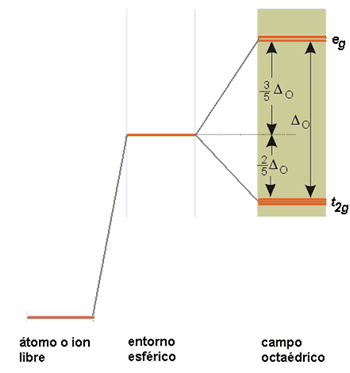
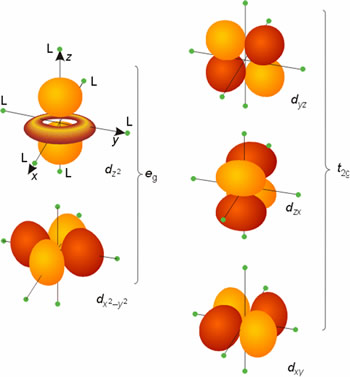
Figura 10. Desdoblamiento de orbitales d en un entorno octaédrico.
El parámetro de desdoblamiento DO varía con la naturaleza de los ligandos y con la del ion metálico central. Así, a partir del valor de O obtenido para una serie de complejos del mismo ion metálico, los ligandos se clasifican en una secuencia denominada serie espectroquímica, la cual es una ordenación de los ligandos según el orden creciente de energía de las transiciones que se observan cuando el ligando se encuentra en el complejo:
I¯<Br¯<S2¯<SCN¯<Cl¯<NO3¯<N3¯<F¯<OH¯<C2O42¯<H2O<NCS¯<CH3CN<py<NH3< <en<bipy<phen<NO2¯<PPh3<CN¯<CO
Los ligandos que aparecen al comienzo de la serie originan DO más pequeños que los que originan aquellos que se encuentran al final de la serie. Los primeros se denominan ligandos de campo débil y los últimos ligandos de campo fuerte.
Los valores de DO también dependen del ion metálico. En este sentido, las variaciones más importantes a tener en cuenta son:
- El estado de oxidación del metal: DO aumenta con el estado de oxidación del centro metálico.
- La naturaleza del ion metálico. Este punto se refiere a la serie de transición a la que pertenece: DO aumenta al descender en un grupo. Así el valor de DO es grande para los metales de la segunda y tercera series de transición.
Para determinar la configuración electrónica del metal de transición en un complejo hay que aplicar el Principio de Construcción. Si además hay más de un orbital degenerado disponible se aplicará la regla de máxima multiplicidad de Hund. Los electrones de los complejos de los tres primeros elementos de la serie 3d ocuparán separadamente los orbitales de menor energía t2g, con sus espines paralelos. Por ejemplo, los iones Ti2+ y V2+ tienen las configuraciones electrónicas 3d2 y 3d3 respectivamente. Para el siguiente ion, Cr2+, de configuración d4, el cuarto electrón puede ocupar un orbital t2g mediante el apareamiento electrónico. En este caso, este electrón experimentará una fuerte repulsión coulombiana, denominada energía de apareamiento, P. Alternativamente, el cuarto electrón puede ocupar uno de los orbitales eg; en este caso, para evitar el apareamiento electrónico el electrón ocupa un orbital de energía más alta (figura 11). En el primer caso, la configuración del complejo sería t2g4, mientras que en el segundo caso, la configuración sería t2g3eg1. La configuración que se adopte dependerá de las magnitudes relativas de los valores de DO y de P en cada caso.
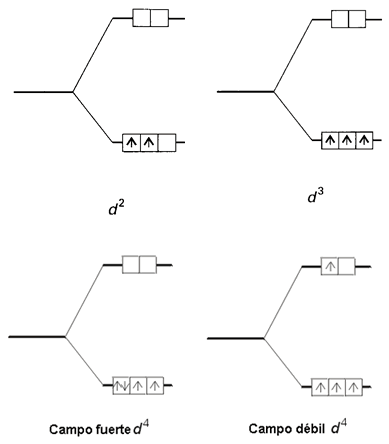
Figura 11. Configuraciones d2-d4 en entorno octaédrico.
Si DO < P, entonces la situación favorable es
la ocupación del orbital de mayor energía eg, ya que
la repulsión electrónica será mínima. Este caso se conoce como configuración
de alto espín, y la configuración posible t2g3eg1 posee el mayor número de electrones desapareados. Si, por el contrario,
DO > P el apareamiento de los
electrones es la situación energéticamente más favorable. Este caso se conoce
como configuración de bajo espín porque la configuración que se obtiene, t2g4,
posee el menor número de electrones desapareados. Este tipo de situaciones sólo
se presenta cuando el ion metálico posee entre 4 y 7 electrones d.
Los valores de DO y de P dependen del tipo de metal y del ligando. Así, los complejos de bajo espín, normalmente, son frecuentes para aquellos ligandos que ocupan los últimos lugares de la serie espectroquímica (como el CN-, CO, etc) cuando se combinan con metales de la serie 3d. Los complejos de alto espín se presentan con ligandos que aparecen al comienzo de la serie espectroquímica (F-, OH-...) en combinación con metales de la primera serie de transición. Por otra parte, en los complejos de los metales de las series 4d y 5d (segunda y tercera series de transición, respectivamente), los valores de DO para estos metales son mayores que para los de la primera serie de transición y, en consecuencia, estos complejos presentan configuraciones electrónicas de bajo espín. Un ejemplo es el complejo [RuCl6]2-, que posee la configuración t2g4a pesar de que el Cl- aparece en los primeros lugares de la serie espectroquímica.
Complejos Tetracoordinados
Los complejos más abundantes, después de los octaédricos, son los complejos tetraédricos y plano-cuadrados. Para describir la estructura electrónica de estos complejos se aplican los mismos argumentos utilizados en la discusión de los complejos octaédricos.
El campo cristalino tetraédrico desdobla también a los orbitales d del ion metálico en dos series, una doblemente degenerada y otra triplemente degenerada: la primera, denominada serie e, tiene menor energía que la serie triplemente degenerada, t2. Esta diferencia, con respecto a la simetría octaédrica, se puede entender si se analiza la disposición espacial de los orbitales en un campo de simetría tetraédrica. Los dos orbitales de simetría e (dz2 y dx2-y2) están dirigidos hacia regiones intermedias entre los ligandos, mientras que los que componen la serie t2 apuntan más directamente hacia los ligandos (Figura 12). Otra diferencia importante con el campo octaédrico es que el parámetro de desdoblamiento del campo de ligandos, DT, en un complejo tetraédrico, es menor que DO, en un complejo octaédrico, como en principio cabe esperar para un complejo que posee un menor número de ligandos (DT < 1/2DO). En consecuencia, todos los complejos tetraédricos son de campo débil y tienen configuración de alto espín.
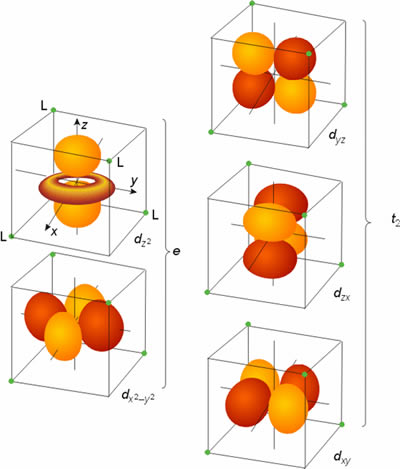
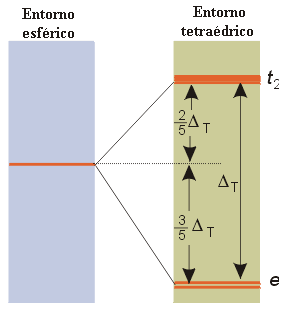
Figura 12. Desdoblamiento de orbitales en un entorno tetraédrico.
Un complejo plano-cuadrado se puede considerar, formalmente, derivado de un complejo octaédrico, que ha experimentado una distorsión tetragonal (alargamiento de los enlaces de los ligandos axiales) hasta una situación límite. Si a un complejo octaédrico regular se le aplica una distorsión tetragonal a lo largo del eje OZ, es decir, un alargamiento según el eje z y un acortamiento o compresión de los ligandos según los ejes x e y, se reduce la energía del orbital dz2 y en menor medida la de todos los orbitales d de componente z (dxz y dyz) y aumenta la energía de los orbitales que tienen componentes x e y, dx2-y2 y dxy. La distorsión tetragonal se presenta en complejos octaédricos de configuración d7-d9 en los que hay electrones ocupando los orbitales eg.
La distorsión tetragonal llega a ser límite en complejos de iones metálicos de configuración d8 (t2g6eg2), en los que llegan a perderse los dos ligandos en el eje z dando lugar a complejos tetracoordinados de geometría plano-cuadrada. Esto ocurre para los iones Rh(I), Ir(I), Pd(II), Pt(II) y Au(III). Para el ion Ni(II) los complejos de composición [NiX4]2- (X = halógeno) son tetraédricos porque los ligandos haluros son ligandos de campo débil. El ion Ni(II) sólo forma complejos plano-cuadrados con los ligandos que ocupan los últimos lugares de la serie espectroquímica (p. ej. CN-).