El oxígeno presenta dos formas alotrópicas: O2 (dioxígeno) y O3 (ozono); dada su relevancia vamos a dedicarles sendas secciones a cada una de ellas.
El dioxígeno, O2
El dioxígeno es un gas incoloro, inodoro y difícil de licuar. Presenta una escasa solubilidad en agua. La solubilidad del O2 en agua es un factor muy relevante ya que tiene que ser suficiente como para permitir que los seres vivos puedan respirar:
0 ºC |
25 ºC |
100 ºC |
|
| S (g/100 g H2O) | 0.007 |
0.004 |
0.001 |
Solubilidad de O2 en agua a distintas temperaturas
Conforme aumentamos la temperatura la solubilidad del oxígeno (y en general la de los gases) disminuye. Esto tiene un indudable impacto en la vida de los organismos acuáticos que utilizan el O2 disuelto en ella para respirar.
Obtención del O2
El oxígeno se produce industrialmente por destilación fraccionada del aire líquido El proceso tiene lugar en una doble columna de destilación. Se enfría el aire hasta licuarlo y se introduce en la columna. La columna inferior se mantiene a una presión de 5 atmósferas, a la cuál los puntos de ebullición de nitrógeno y oxígeno son mucho más altos que en condiciones normales. En la columna empieza a evaporar el nitrógeno mientras que el oxígeno, menos volátil, queda en el fondo. Controlando cuidadosamente las condiciones de temperatura y presión, se pueden separar ambos gases
Escala de laboratorio: hay dos métodos habituales
a) Descomposición del peróxido de hidrógeno en presencia de dióxido de manganeso MnO2 que actúa como catalizador de la descomposición:
2 H2O2 (l) (Cat. MnO2) → 2 H2O (l) + O2 (g)
b) Descomposición térmica del clorato potásico:
2 KClO3 (s) → 2 KCl (s) + 3 O2 (g)
Dicha descomposición necesita de una temperatura de unos 400-500 ºC. La adición de MnO2 logra que la temperatura de descomposición baje hasta los 150 ºC. También se puede obtener dioxígeno por electrolisis del agua. El inconveniente es gasto de electricidad que supone. El interés por obtener hidrógeno (ver economía del hidrógeno en el tema 5) partiendo del agua como materia prima quizás provoque que en el futuro haya otros métodos de obtención industrial alternativos a la destilación fraccionada del aire líquido.
Aplicaciones
El dioxígeno tiene un buen número de aplicaciones en el mundo moderno. Se utiliza por ejemplo en medicina en la respiración asistida de los pacientes; en todos los hospitales encontraremos grandes depósitos de oxígeno líquido. Además, es esencial en el proceso de combustión de azúcares mediante el cual la mayor parte de los seres vivos obtienen energía:
6CO2 + 6H2O + energía → C6H12O6 + 6 O2
La mayor parte del oxígeno (80% de la producción mundial) se destina a la industria del hierro y del acero (proceso Bessemer). Cada tonelada de acero necesita para su obtención de 3/4 tn de oxígeno.
Otros usos:
- preparación de TiO2 a partir de TiCl4
- oxidación del NH3 en la fabricación de HNO3
- combustible (oxidante) en cohetes espaciales
- producción gas de síntesis (CO+ H2O)
- oxidación directa de etileno a óxido de etileno
Estructura electrónica del O2
La molécula de dioxígeno es paramagnética. El momento magnético es el correspondiente a dos electrones desapareados, de acuerdo con lo previsto por la TOM.
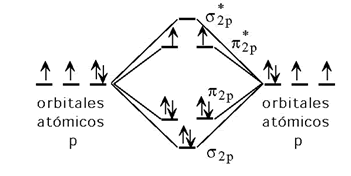
La molécula de dioxígeno dispone de 12 electrones; cuatro de ellos permanecen en orbitales de tipo s muy bajos en energía y que no tenemos en consideración en el diagrama de OM que se presenta. Los 8 electrones restantes se disponen en el esquema adjunto.
A pesar de su elevada reactividad, la mayor parte de los procesos oxidativos transcurren lentamente debido a la energía necesaria para excitar la molécula de dioxígeno. Si dichos procesos oxidativos en los que está implicado el O2 estuvieran gobernados por la termodinámica en vez de por la cinética toda la materia orgánica se oxidaría rápidamente, los hidrocarburos se incendiarían espontáneamente, etc.
Un agente oxidante poderoso puede arrancar uno de los electrones p* del dioxígeno para dar el catión O2+ que puede formar redes estables con polifluoroaniones grandes como BF4- o PF6-. Asimismo puede captar un electrón adicionándolo a uno de esos orbitales p* semiocupados para dar el anión superóxido O2- que puede formar redes estables con cationes alcalinos y alcalino-térreos (CsO2). Se puede captar un segundo electrón originando el anión peróxido -O–O- como por ejemplo en el Na2O2.
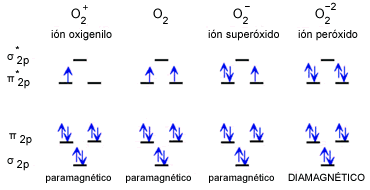
Configuración electrónica en el estado fundamental de especies diatómicas homonucleares derivadas de la molécula de O2