Reacciones típicas de los isocianatos
Reacciones con compuestos que contiene hidrógeno activo. Estas son las reacciones más características de los isocianatos:
RNCO
+ HX ![]() RNHCOX
RNHCOX
La reacción se produce generalmente con un catalizador a la temperatura ordinaria o después de calentamiento moderado sin catalizador. Los catalizadores de la reacción Friedel-Crafts, las aminas terciarias y el naftenato de cobalto catalizan casi todas las reacciones de este tipo.
Los isocianatos son hidrolizados por el agua con grados variables de rapidez y dan la urea desustituida correspondiente
RNCO
+H2O ![]() RNHCOOH
RNHCOOH
![]() RNH2+CO2
RNH2+CO2
RNH2 + RNCO ![]() RNHCONHR
RNHCONHR
Los ácidos halogenhidricos se combinan reversiblemente con los isocianatos para dar haluros de carbamilo monosustituidos
RNCO
+ HCl ![]() RNCOCl
RNCOCl
Estos haluros de carbamilo son estables a las temperaturas ordinarias, pero se disocian a temperaturas próximas a 100ºC .
Casi todos los compuestos que contiene hidrógeno unido a un nitrógeno reaccionan con los isocianatos:
RN=C=O
+ HN< ![]() RNHCON<
RNHCON<
Las aminas dan urea, las amidas forman acilureas y las ureas producen biuretes. Las aminas reacción con mucha mas rapidez que las amidas y las ureas, de modo que la reacción puede controlarse para obtener el producto deseado.
Los compuestos que contienen hidrógeno unido a oxigeno reaccionan de manera semejante y dan uretanos:
RNCO
+ R'OH ![]() RNHCOOR'
RNHCOOR'
Los ácidos carboxílicos dan generalmente amidas. y dióxido de carbono, con la formación de anhídridos como intermedios:
RNCO
+ R'COOH ![]() RNHCOOCOR'
RNHCOOCOR'
![]() RNHCOR' + CO2
RNHCOR' + CO2
Los compuestos enolizables , como los ésteres malónicos, reaccionan en presencia de sodio:
RNCO
+ NaCH(COOC2H5)2![]() RNHCOCH(COOC2H5)2
RNHCOCH(COOC2H5)2
En general, los compuestos de azufre se comportan de la misma manera que sus análogos del oxígeno.
El bisulfito de sodio en solución acuosa reacciona reversiblemente con los isocianatos, sobre todo con los derivados alifáticos, para dar derivados estables y solubles en agua:
RNCO
+ NaHSO2![]() RNHCOSO2Na
RNHCOSO2Na
Además de las reacciones usuales con el, hidrógeno activo, pueden realizarse las reacciones de Friedel‑Crafts y Grignard con los isocianatos para producir amida.
Muchas de las reacciones anteriormente descritas se invierten calentando, entre ellas las reacciones con los haluros de hidrógeno, las aminas, los alcoholes, los fenoles, el bisulfito de sodio y los compuestos de metileno activo.
Polimerización
Un segundo tipo de reacción de los isocianatos es la polimerización. Los derivados aromáticos suelen formar dímeros, mientras que los derivados alifáticos dan trímeros:
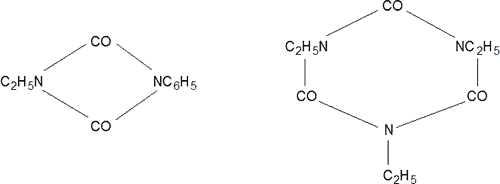
Las polimerizaciones pueden efectuarse por medio del calor o por catalizadores ácidos, básicos y peróxidos. Los diisocianatos son especialmente sensibles a la polimerización.
En muchos casos el dímero de isocianato da reacciones semejantes a las del propio isocianato. Así, el dímero isocianato de fenilo reacciona con fenol para dar carbanilato, de fenilo:
(C6H5NCO)2 + 2 C6H5OH
![]() 2 C6H5NHCOOC6H5
2 C6H5NHCOOC6H5
Análisis de isocianatos
Los isocianatos se valoran fácilmente por la reacción con un peso conocido de una amina secundaria, como la dibutilamina, y valoración del exceso de amina con solución volumétrica de un ácido.
Preparación de isocianatos
Se han descrito muchos métodos para la preparación de los isocianatos. Estos métodos se clasifican por la reacción que interviene. El método usado es la reacción entre una amina o su sal y el fosgeno. Las transformaciones de Curtius, Hofmann y Lossen y las reacciones de doble descomposición se han usado mucho.
Reacciones de fosgeno.
Hentschel demostró en 1884 que por la reacción entre el fosgeno y la sal de una amina primaria podía obtenerse un isocianato. Después se han desarrollado varias modificaciones de esta reacción. Esta reacción es especialmente útil para los isocianatos y los diisocianatos de alto punto de ebullición, que se obtienen fácilmente y con buenos rendimientos por la reacción del fosgeno con una lechada del clorhidrato de la amina en tolueno o diclorobenceno.
Se ha ideado una reacción en fase gaseosa entre aminas y fosgeno para la preparación de monoisocianatos que contienen hasta once átomos de carbono. El isocianato propiamente dicho se obtiene si se condensa el producto por encima de 100ºC ; si el producto se condensa en frío se aísla el cloruro de carbamilo.
Transformaciones de Curtius, Hofmann y Lossen.
Un método distinto de la reacción del fosgeno y que se utiliza mucho es la transformación de Curtius de una azida ácida disuelta en un líquido neutro.
RCON3 {RCON< } ![]() RNCO
RNCO
El método fue primero desarrollado en grado considerable por Schroeter quien preparo varios isocianatos con buenos rendimientos tratando un cloruro de ácido con azida de sodio y calentando el producto en solución bencénica.
La transformación de Hofmann de amidas y la transformación de Lossen de ácidos hidroxámicos se utilizan también aunque menos.
Reacciones de doble descomposición
La reacción entre haluros o sulfatos orgánicos y sales del ácido ciánico fue el método utilizado por Wurtz para la preparación de los isocianatos alquílicos:
R2SO4+ KCNO ![]() RNCO
RNCO
Propiedades físicas y químicas de algunos isocianatos
Propiedades |
TDI |
MDI |
HDI |
NDI |
IPDI |
|---|---|---|---|---|---|
| Fórmula | C9H6N2O2 | C15H10N2O2 | C8H12N2O2 | C12H6N2O2 | C12H18N2O2 |
| CAS | 584-84-9 | 101-68-4 | 822-06-0 | 3173-72-6 | 4098-71-9 |
| Peso molecular | 174.16 | 250.3 | 168.0 | 210.19 | 222.29 |
| Punto de ebullición | 251ºC | 314ºC | 212.8ºC | 263ºC | 158ºC |
| Densidad | 1.22 | 1.23 | 1.04 | 1.42 | 1.062 |
| Presion Vapor (mm Hg) |
0.05 (25ºC) | 0.00014 (25ºC) | 0.05 (24ºC) | 0.004 (24ºC) | 0.0003 (20ºC) |
| Punto de Ingnición | 135ºC | 195ºC | 140ºC | 155ºC | 155ºC |
| Solubilidad | Hidrocarburos aromáticos, nitrobenceno, acetona, éter, ésteres | Hidrocarburos, nitrobenceno, acetona, éter, ésteres | Solventes orgánicos | hidrocarburos alifáticos y aromáticos, cetonas, éteres y ésteres | |
| Nomenclatura Química | Toluen 2,4 diisocianato | 4,4 Difenilmetano diisocianato | Hexametilen diisocianato | 1,5 naftalen diisocianato | isoforona diisocianato |