El azufre, al igual que el N y el P, forma numerosos oxoácidos, y aunque algunos de ellos ácidos pueden ser aislados como tales ácidos libres, la mayoría se conocen como las sales de los correspondientes oxoaniones.
Oxoácidos de azufre
| Nombre ácido | Fórmula | Nombre oxoanión | Fórmula |
|---|---|---|---|
| Ac.
Sulfuroso* Ac. Disulfuroso* Ac Sulfúrico Ac.Tiosulfúrico* Ac. Di(Piro)sulfúrico Ac. Ditionoso* |
H2SO3 H2S2O4 H2SO4 H2S2O3 H2S2O7 HO2S–SO2H |
Sulfito Disulfito Sulfato Tiosulfato Pirosulfato Ditionito |
SO32- -O2S-SO2- SO42- S2O32- -O3S-O-SO3- -O2S-SO2- |
| Ac.
Ditiónico Ac. Politiónico# Ac. Peroxosulfúrico# Ac. Peroxodisulfúrico |
HO3S–SO3 HHO3S(S)nSO3 HH2SO5 H2S2O8 |
Ditionato Politionato Peroxosulfatos Peroxodisulfatos |
-O3S-SO3- -O3S-Sn-SO3- SO52- -O3S-OO-SO3- |
*No se conoce el ácido libre;
sólo sus sales.
#Se conoce el ácido diluido, no
en estado puro y sus sales.
Para enfatizar sus similitudes estructurales podemos dividirlos en tres series:
- Oxoaniones “sencillos”: sulfito (SO32-), sulfato (SO4-2) y tiosulfato (S2O32-).
- Agrupaciones aniónicas unidas por un átomo de oxígeno: anión pirosulfato (S2O72-) y peroxodisulfato.
- Agrupaciones aniónicas unidas por átomos de azufre: ditionito, politionatos
El ácido sulfuroso y los sulfitos
El SO2 es muy soluble en agua. Sus disoluciones, que poseen propiedades ácidas, se consideraron durante mucho tiempo como disoluciones del ácido sulfuroso, H2SO3. Sin embargo, mediante métodos físicos modernos se ha podido demostrar que el H2SO3 no existe en absoluto o sólo se halla en cantidades extremadamente pequeñas. En cambio, sí se pueden detectar en disolución los aniones sulfito y bisulfito.
Se pueden escribir tres estructuras de Lewis para describir la estructura electrónica de este anión:
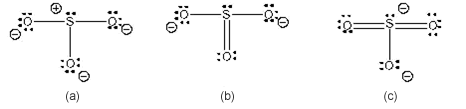
Las distancias de enlace en el ión sulfito son ligeramente mayores que aquellas de un enlace doble S=O. A pesar de que es posible escribir estructuras de Lewis sólo con enlaces sencillos (a), estas estarán inestabilizadas respecto a aquellas en tienen dobles enlaces en la molécula (b) y (c). La estructura (c) sitúa una carga parcial negativa sobre el S lo cual no es muy favorable ya que la carga negativa tiende a situarse sobre los elementos más electronegativos.
El sulfito sódico es uno de los productos que se sintetizan en mayor cantidad (106 tn/año). Se obtiene pasando SO2 a través de una disolución de Na2CO3. En la industria y en el laboratorio químico el sulfito sódico se utiliza como agente reductor moderado. El principal uso en la actualidad está relacionado con la fabricación de papel. Como el SO2, el sulfito sódico también se utiliza como un conservante en la industria de la alimentación (se emplea para que los vegetales mantengan la apariencia de frescos, sin embargo pueden causar serias reacciones alérgicas).
El ácido sulfúrico y los sulfatos
El ácido sulfúrico es, con diferencia, el más importante de todos los ácidos del azufre. Es también el producto industrial más importante del mundo, hasta el punto de que su consumo es un indicador de la actividad industrial de un país. Se utiliza en la fabricación de muy diversos compuestos como los fertilizantes (superfosfatos, o combinación de sulfato y nitrato amónico), las fibras sintéticas como el rayón en la fabricación del cuero, la hojalata, de algunos pigmentos y detergentes, de explosivos, plásticos y herbicidas; o en procesos como la purificación de petróleo y en numerosas reacciones en la Química Orgánica.
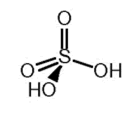
El ácido sulfúrico puro es un líquido denso, viscoso y aceitoso que empieza a hervir a 290 ºC descomponiéndose en SO3 (gas) y agua. Es miscible con agua en todas las proporciones, siendo esta reacción extremadamente exotérmica (880 kJmol-1), llegando a ser explosiva. Por ello debe ser añadido, lentamente sobre el agua y NUNCA AL REVÉS agitando la disolución para procurar una efectiva disipación del calor generado. El ácido sulfúrico concentrado de laboratorio (18 M) es altamente corrosivo.
Obtención del ácido sulfúrico
La manufactura del ácido sulfúrico empezó hace más de 400 años, cuando el ácido se conocía como aceite de vitriolo y se destilaba del “vitriolo verde” (FeSO4·7H2O) El método del vitriolo verde y los varios métodos de producción usados han sido reemplazados por el proceso de contacto moderno, que se basa en la oxidación catalítica del SO2 a SO3. Este proceso consta de cuatro pasos claves.
1. Obtención de azufre. En la mayoría de los países hoy, la producción del ácido sulfúrico empieza con la producción del azufre elemental, por alguno de los métodos que se han descrito en la sección 15.3.
2. Del azufre al dióxido de azufre. Una vez obtenido, el azufre se quema al aire para formar SO2:
1/8S8(s) + O2(g)→ SO2(g) ΔHº = -297 kJ mol-1
Algo del SO2(g) también se obtiene del calcinado de menas de sulfuros metálicos. Cerca del 90% de azufre procesado se usa para fabricar dióxido de azufre para la producción del todo importante ácido sulfúrico. Estados Unidos, Rusia, Japón y Alemania son los cuatro primeros productores de azufre.
3. Del dióxido de azufre al trióxido. El proceso de contacto oxida al SO2 con O2 a SO3:
SO2(g) + ½ O2(g) → SO3(g) ΔHº = -99kJmol-1.
La reacción es exotérmica y muy lenta a temperatura ambiente. Del principio de Le Chatelier sabemos que la producción de SO3 puede incrementarse al 1) cambiar la temperatura, 2) aumentar la presión (más moles de gas están en el lado izquierdo que en el derecho) y 3) ajustando las concentraciones (añadiendo exceso de O2 y eliminando SO3)
Primero examinaremos el efecto de la temperatura. Añadir calor (subiendo la temperatura) aumenta la frecuencia de las colisiones SO2-O2 y así aumenta la velocidad de SO3. No obstante, como la formación de SO3 es exotérmica, el eliminar calor (bajando la temperatura) cambia la posición del equilibrio hacia la derecha y así aumenta el rendimiento de SO3. Ésta es una situación clásica que requiere el uso de un catalizador. Al disminuir la energía de activación, un catalizador permite que el equilibrio se alcance más rápido y a una temperatura menor; así la velocidad y el rendimiento se optimizan. El catalizador en el proceso de contacto es el V2O5 sobre sílice inerte, que se activa entre 400 y 600 ºC.
El efecto de la presión es pequeño y económicamente no merece la pena explotarlo. Los efectos de concentración se controlan proveyendo un exceso de O2 en la forma de una mezcla 5:1 de aire:SO2, ó 1:1 O2:SO2, cerca de dos veces más de O2 del necesario para la reacción estequiométrica. La mezcla se pasa sobre capas de catalizador en cuatro pasos, y el SO3 se elimina en varios puntos para favorecer la formación de más SO3. El rendimiento total en SO3 es de 99.5%.
4. Del SO3 al ácido sulfúrico. El trióxido de azufre es el anhídrido del ácido sulfúrico, y entonces la hidratación es el siguiente paso. No obstante, al SO3 no puede añadírsele agua porque, a la temperatura de operación, se encontrará primero con vapor de agua, lo cual cataliza la polimerización a (SO3)x, y resulta un humo de partículas sólidas que hace un contacto deficiente con el agua. Para prevenir esto, el SO3(g) se burbujea a través de ácido sulfúrico al 98% en torres rellenas de material cerámico. El SO3(g) se disuelve fácilmente en el ácido sulfúrico y forma el ácido pirosulfúrico (o ácido disulfúrico, H2S2O7) que se hidroliza después con suficiente agua:
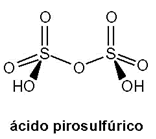
H2S2O7 (l) + H2O (g) → 2 H2SO4 (l)
El resultado es una forma de ácido sulfúrico que se llama a veces oleum y más frecuentemente ácido sulfúrico fumante.