Estas sales, junto con los nitratos de metales, son las más utilizadas. En el caso de los sulfatos por varias razones: (i) su solubilidad en agua, por lo que son fuentes de cationes metálicos (salvo dos excepciones: el PbSO4 (baterías Pb) y el BaSO4 (usado para RX de tejidos blandos como el estómago)); (ii) el ión sulfato no es ni oxidante ni reductor, lo que facilita que forme sales con metales en altos y bajos estados de oxidación. Además en disolución no inicia reacciones redox con ningún ion presente; (iii) es la base conjugada de un ácido moderadamente fuerte (HSO4-) por lo que la disolución de la sal no altera significativamente el pH; (iv) son térmicamente estables, mucho más que sus correspondientes nitratos. En general los sulfatos se obtienen haciendo reaccionar ácido sulfúrico con un metal, óxido, hidróxido o carbonato.
Los sulfatos alcalinos y alcalino-térreos son muy estables. Los sulfatos alcalinos son sustancias iónicas con altos puntos de fusión y bastante solubles en agua.
Alcalinos |
T. fusión (ºC) |
Alcalinotérreos |
T. fusión(ºC) |
|---|---|---|---|
| Li2SO4 Na2SO4 K2SO4 Rb2SO4 Cs2SO4 |
845 885 1067 1060 1019 |
BeSO4 MgSO4 CaSO4 SrSO4 BaSO4 |
550-600 1124 1450 1605 >1600 |
Entre los sulfatos de uso cotidiano podemos destacar los siguientes:
El Sulfato de sodio: Su forma Na2SO4·10H2O (sal de Glaurbert) se utiliza en la fabricación de vidrio. Si se calienta a 32 ºC, es decir, a temperatura ambiente un poco alta, se disuelve en las aguas de cristalización. El proceso absorbe una gran cantidad de calor debido a su elevado calor latente de fusión. Esto permite utilizarlo como una forma de almacenar el calor generado por el sol. El calor diurno se puede utilizar para disolver el sulfato que cuando recristaliza por la noche libera ese calor. La forma anhidra se utiliza como desecante.
El sulfato de magnesio . Se utiliza como laxante. Previene la absorción de agua en el cuerpo. Al haber más agua de lo normal en los intestinos se produce esa acción laxante. En su forma deshidratada es un poderoso desecante
Sulfato cálcico CaSO4•2H2O conocido vulgarmente como yeso. Las famosas rosas del desierto son cristales de sulfato de calcio cristalizado. Por calentamiento a 150 ºC pierde parte del agua de cristalización convirtiéndose en el hemihidrato, CaSO4•1/2 H2O, que es el constituyente del material de construcción (al recuperar las moléculas de agua se endurece en el fenómeno denominado fraguado). Una de las formas del yeso es el alabastro que es relativamente blando lo que lo convierte en un excelente material para hacer esculturas.
El Sulfato de cobre: el sulfato de cobre cristaliza en unos cristales de un color azul intenso. Se puede obtener haciendo reaccionar ácido sulfúrico con carbonato de cobre:
H2SO4 (ac) + CuCO3 (s) → CuSO4 (ac) + CO2 (g) + H2O (l)
Se utiliza ampliamente como fungicida. Se utilizaba antiguamente para prevenir la putrefacción de las semillas antes de que pudieran ser utilizadas. Previene la formación de verdina en las piscinas. La forma deshidratada (de color blanco) se utiliza como agente desecante.
Otras oxosales
Los tiosulfatos: el anión tiosulfato S2O3-2 recuerda al sulfato, excepto que un oxígeno se ha sustituido por un S (tio significa azufre). Los dos átomos de S están en entornos químicos diferentes, uno es central y el otro terminal. El más utilizado de todos los tiosulfatos es el tiosulfato sódico:
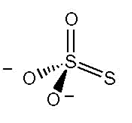
Na2SO3 (ac) + S (s) → Na2S2O3 (ac)
Usos del tiosulfato sódico
1.- Sistema de almacenamiento de calor. Con el calor solar diurno, se deshidrata el tiosulfato; por la noche la rehidratación provoca la liberación de calor.
2.- En fotografía se utiliza para eliminar los restos de AgBr que no han sido reducidos a Ag durante el proceso de revelado. La eliminación de dichos restos es imprescindible antes de que la película pueda ser expuesta a la luz. Tras este proceso, denominado fijado, la película es estable y puede ser expuesta a la luz sin problemas. La eliminación se realiza con el tiosulfato sódico (o amónico) que disuelve el bromuro de plata formando un complejo soluble en agua, y por tanto de eliminación fácil:
AgBr (s) + 2 S2O3-2 (ac) ® [Ag(S2O3)3]-5 (ac) + Br- (ac)
3.- También se utiliza en valoraciones redox, como la determinación de I- en disolución acuosa:
2 S2O3-2 (ac) ® S4O6-2 (ac) + 2e-
I2(ac) + 2e- ® I-(ac)
La especie S4O6-2 se denomina tetrationato y su estructura contiene un puente S-S análogo al puente peroxo en el peroxodisulfato:
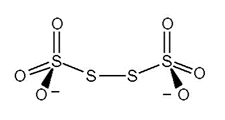
Los peroxodisulfatos
El anión sulfato puede ser oxidado electrolíticamente al anión peroxodisulfato. Las condiciones deben ser controladas con cuidado para evitar la oxidación competitiva de agua a dioxígeno:
2 HSO4- → S2O82- + 2H+(ac) + 2e-
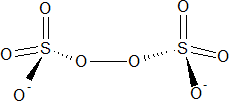
Los enlaces S-O terminales son equivalentes con un marcado carácter de doble enlace; d(S-Oterminal) = 1.50Å La característica más importante del peroxodisulfato es su poder como agente oxidante:
S2O82- + 2e- → 2 SO4- Eo = 2.01 V
El anión peroxodisulfato es un agente oxidante enérgico y valioso. Es capaz de oxidar al ión manganeso a permanganato y al ión cromito a dicromato.