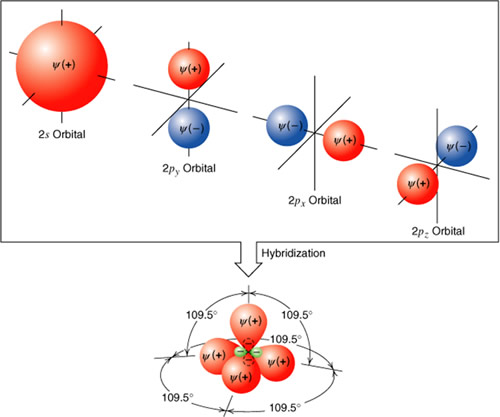
La hibridación consiste en una mezcla de orbitales puros en un estado excitado para formar orbitales hibridos equivalentes con orientaciones determinadas en el espacio.
Hibridación sp3 o tetraédrica
Para los compuestos en los cuales el carbono presenta enlaces simples, hidrocarburos saturados o alcanos, se ha podido comprobar que los cuatro enlaces son iguales y que están dispuestos de forma que el núcleo del átomo de carbono ocupa el centro de un tetraedro regular y los enlaces forman ángulos iguales de 109º 28' dirigidos hacia los vértices de un tetraedro. Esta configuración se explica si se considera que los tres orbitales 2p y el orbital 2s se hibridan para formar cuatro orbitales híbridos sp3.
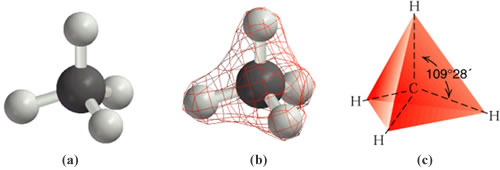
metano CH4
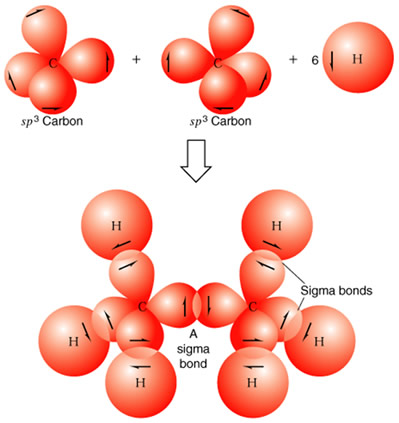
etano CH3-CH3
Hibridación sp2
En la hibridación trigonal se hibridan los orbitales 2s, 2px y 2 py, resultando tres orbitales idénticos sp2 y un electrón en un orbital puro 2pz .
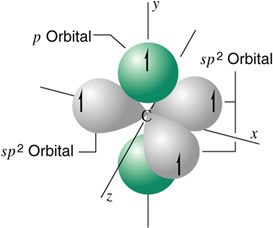
Un átomo de carbono hibridizado sp2
El carbono hibridado sp2 da lugar a la serie de los alquenos.
La molécula de eteno o etileno presenta un doble enlace:
- un enlace de tipo σ por solapamiento de los orbitales hibridos sp2
- un enlace de tipo π por solapamiento del orbital 2 pz
El enlace π es más débil que el enlace σ lo cual explica la mayor reactividad de los alquenos, debido al grado de insaturación que presentan los dobles enlaces.
El doble enlace impide la libre rotación de la molécula.
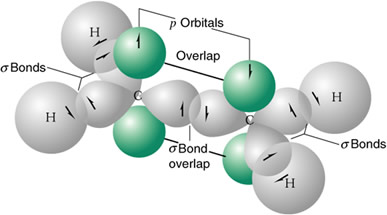
Modelo de enlaces de orbitales moleculares del etileno formado a partir de dos átomos de carbono hibridizados sp2 y cuatro átomos de hidrógeno.
Hibridación sp
Los átomos que se hibridan ponen en juego un orbital s y uno p, para dar dos orbitales híbridos sp, colineales formando un ángulo de 180º. Los otros dos orbitales p no experimentan ningún tipo de perturbación en su configuración.
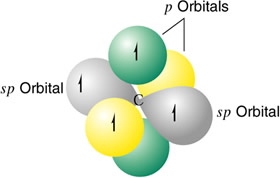
Un átomo de carbono hibridizado sp
El ejemplo más sencillo de hibridación sp lo presenta el etino. La molécula de acetileno presenta un triple enlace:
a. un
enlace de tipo σ por solapamiento de los orbitales hibridos sp
b. dos
enlaces de tipo π por solapamiento de los orbitales 2 p.
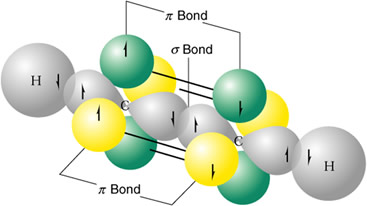
Formación de orbitales de enlaces moleculares del etino a partir de dos átomos de carbono hibridizados sp y dos átomos de hidrógeno.
Angulo de enlace
Es el formado por las líneas internucleares H - C - H o H - C - C. El ángulo de enlace determina la geometría que tiene la molécula, y ésta a su vez determina el grado de estabilidad y las propiedades químicas y físicas de una sustancia.
Hibridación sp3
Si los átomos que enlazan con el carbono central son iguales, los ángulos que se forman son aproximadamente de 109º 28' , valor que corresponde a los ángulos de un tetraedro regular.
Cuando los átomos son diferentes, por ejemplo CHCl3, los cuatro enlaces no son equivalentes. Se formarán orbitales híbridos no equivalentes que darán lugar a un tetraedro irregular. Esta irregularidad proviene de los diferentes ángulos de enlace del carbono central, ya que la proximidad de un átomo voluminoso produce una repulsión que modifica el ángulo de enlace de los átomos más pequeños. Así, el ángulo de enlace del Br - C - Br es mayor que el tetraédrico por la repulsión que originan los dos átomos voluminosos de bromo.
Hibridación sp2
La molécula tiene geometría trigonal plana en la que los ángulos de enlace H - C - C son de 120º.
Hibridación sp
La molécula tiene geometría lineal y el ángulo H - C - C es de 180º.
Tipos de hibridación del carbono
Tipo de hibridación |
Orbitales |
Geometría |
Ángulos |
Enlace |
|---|---|---|---|---|
| sp3 | 4 sp3 | Tetraédrica |
109º 28’ | Sencillo |
| sp2 | 3 sp2 1 p |
Trigonal plana |
120º | Doble |
| sp | 2 sp2 p | Lineal |
180º | Triple |
Longitud de enlace
Es la distancia entre los núcleos de los átomos que forman el enlace.
Radio covalente
Es la mitad de la longitud de un enlace covalente entre dos átomos iguales.
Radios covalentes atómicos en unidades ángstrom (Å)
Enlaces |
H |
C |
N |
O |
F |
Cl |
Br |
I |
|---|---|---|---|---|---|---|---|---|
| Simple | 0.30 |
0.77 |
0.70 |
0.66 |
0.64 |
0.99 |
1.04 |
1.33 |
| Doble | – |
0.67 |
0.61 |
0.55 |
– |
– |
– |
– |
| Triple | – |
0.60 |
0.55 |
– |
– |
– |
– |
– |
Enlaces |
Distancia C |
Energía Kj/mol |
|---|---|---|
C – C |
1'54 |
347 |
C = C |
1'34 |
598 |
C ≡ C |
1'20 |
811 |