En este tema estudiaremos las diferentes reacciones que tienen lugar en el proceso de combustión
Parámetros de la combustión
Si queremos aprovechar toda la energía de un combustible es necesario que la combustión se realice en las mejores condiciones posibles. Hablaremos de la corrección en la realización de la combustión. Incluimos en la combustión la caldera, que es el lugar donde se produce la combustión.
Para aprovechar bien la energía que se desprende en la reacción de oxidación de los elementos combustibles es necesario que se realice en las mejores condiciones posibles. Para ellos deberemos hacer que todo el carbono se transforme en CO2, que no haya inquemados sólidos o gaseosos, que no haya pérdidas de calor por la formación de inquemados, que el aire sea bien empleado en todo el proceso de combustión. Cumpliendo todo estos requisitos tendríamos la combustión completa. La caldera en este proceso es fundamental para la buena marcha del mismo; en general, todos los equipos empleados en la combustión van a ser importantes para la buena marcha de la misma.
Combustión estequiométrica
Consideramos como elementos combustibles el C, H2 y el S. De este modo, el proceso de combustión se puede resumir en el siguiente cuadro:
Composición |
Reacción de combustión |
Moles |
Comburente |
Gases de combustión |
||
|---|---|---|---|---|---|---|
Elemento |
% (Kg) |
Oxidación |
n |
nO2 |
Componente |
Moles |
C |
A |
C+O2 (1:1: 1) |
CO2 |
nCO2=nC |
||
H2 |
B |
H2+½O2 (1:½ 1) |
H2O |
nH2O=nH2 |
||
S |
D |
S+O2 (1: 1: 1) |
SO2 |
nSO2=nS |
||
nGc=∑ni |
||||||
El volumen de los gases de combustión lo calcularíamos de la siguiente manera:
| Gas | Volumen de gases de combustión (VGC) |
|---|---|
CO2 |
VCO2 = 22’4*nCO2 |
H2O |
VH2O = 22’4*nH2O |
SO2 |
VSO2 = 22’4*nSO2 |
Vtotal= VCO2+VH2O+VSO2 |
Queremos ahora saber los moles mínimos, es decir, la cantidad mínima de oxígeno necesaria para la reacción de combustión. Este aire nos lo va a aportar el aire. Como sabemos el aire está formado, en volumen, por 79% de N2 y un 21% de O2. El aire mínimo, referido al porcentaje de oxígeno, será:
![]()
Hay que tener en cuenta que este aire se toma directamente de la atmósfera, y que esto implica que las condiciones en las que está este aire pueden variar: humedad relativa, temperatura, presión vapor, presión real.
Esto implica que para la cantidad de aire necesaria hace falta un aire húmedo en una cantidad superior. El aire húmedo mínimo viene dado por:
Amh= F*AmEl parámetro F (factor de correción) viene dado por:
donde PS: presión de saturación (a la temperatura del aire)
Pr: Presión atmosférica
De esta manera, Amh está en C/N, pero está claro que el aire que vamos a tomar de la atmósfera no va a estar en esas condiciones de manera general. Si se cumplen las condiciones del gas ideal, entonces podremos poner que:
![]()
![]()
![]()
El nitrógeno aportado por el aire pasa directamente a los gases de combustión.
Para que pueda realizarse la combustión completa va a ser necesario aportar un exceso de aire. Tendremos entonces cierta cantidad de oxígeno que no reacciona y N2 adicional, que es la cantidad que difiere de la cantidad teórica.
El exceso de aire se mide por el índice de exceso de aire, que es el cociente entre el aire real y el aire mìnimo. El exceso de aire es la diferencia entre n y 1, es decir, n-1.
Índice de exceso de aire =Los combustibles que requieren menos porcentaje de exceso de aire para su combustión son los gaseosos, y los que más, son los sólidos.
Si tenemos exceso de aire, en los gases de combustión tendremos:
CO2
H2O
SO2
Oxígeno
en exceso: O2 del exceso de aire - O2 mínimo
N2
del exceso de aire
Lo que habrá que calcular será:
O2m
Am
Amh
Ar
n (índice de exceso de aire)
%(n-1)
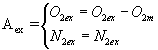
En cuanto a los humos que se produce, serán húmedos y secos:
HTH = CO2 + H2O + SO2 +(O2ex-O2min)+N2ex
HTS = HTH - H2O
Composición y cantidades de los gases de combustión
Se refieren siempre a la cantidad de combustible que se ha quemado. La composición de los gases de combustión se hace estableciendo relación entre los gases que se producen; está relación puede ser de porcentaje en peso y en volumen, de tanto por 1,...
Haciendo un cuadro de la combustión es fácil y rápido calcular estas proporciones.
Cálculo rápido de aire y gases de combustión
Para combustibles líquidos, en caso de que no se conozca la composición excata, se pueden usar unas gráficas que nos ayudan a determinar el aire mínimo y los gases de combustión de una manera aproximada.
La relación entre el aire mínimo y el combustible líquido es una relación lineal. Usando las gráficas podemos averiguarla, siempre que los parámetros no se necesiten de una manera muy exacta.
Combustión incompleta
La combustión incompleta es aquella que se realiza sin que todo el carbono del combustible pueda transformarse en CO2. Se va a realizar, pues, con defecto de oxígeno, o lo que es lo mismo, con defecto de aire. Las reacciones que van a tener lugar son:
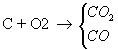
H2 + ½O2![]() H2O
H2O
S
+ O2![]() SO2
SO2
En la combustión incompleta no todo el carbono se transforma en CO2, por lo que se forman inquemados, tanto sólidos (hollín) como gaseosos (CO).
Los cálculos a efectuar en este tipo de combustiones son los mismos que en la combustión completa, solo que deberemos conocer la fracción de carbono que se transforma en CO2 y en CO. Una vez conocido este dato, el resto de los cálculos serán análogos a los realizados para la combustión completa. Una diferencia con la combustión completa está en la composición de los gases de combustión, que ahora contendrán: HTH: CO2+CO+H2O+SO2+N2 HTH: CO2+CO+H2O+N2+O2Tipos de combustión incompleta
Pseudocombustión oxidante (PCO)
La PCO es aquella reacción de combustión en la que los humos obtenidos en la misma contienen todos los elementos que cabría esperar de una combustión con exceso de aire y además, las partículas de carbonos sin quemar (inquemados sólidos). Es decir, los humos estarían formados por:
H = HTH (combustión completa) + C(S) (inquemados)
Este tipo de combustión incompleta se produce cuando el tiempo de reacción no es suficiente para que se pueda llegar a realizar.. Esto puede ser debido al factor de potencia (volumen en el hogar, que haya turbulencias, falta de uniformidad para la pulverización en combustibles líquidos..) Otro factor puede ser el enfriamiento de la llama, que se origina cuando la mezcla aire-combustible incide sobre una superficie relativamente fría, o cuando se trabaja con un exceso de aire. Si existe un alto porcentaje de CO2 en los gases de combustión también se puede producir una PCO
Pseudocombustión neutra (PCN)
Las PCN son un caso particular dentro de las PCO y se caracterizan por:
1) La concentración de CO es prácticamente nucla en los gases de combustión (humos secos)
2) No existe O2 en los gases de combustión
Otro caso de combustión incompleta son las que se realizan con defecto de aire (n<1). El estudio de estas combustiones es muy complicado, ya que es muy difícil llegar a deducir que elementos se han quemado y cuales no. Son más fáciles de estudiar si se empiezan analizando los gases de combustión, deduciendo a partir de aquí como transcurre la combustión
Diagramas de combustión
Los diagramas de combustión nos permiten efectuar cálculos de combustión de una forma rápida y bastante precisa. El realizar estos diagramas es ciertamente complicado. Los principales diagramas son los de Gunte, Ostwald, Keller. Cada diagrama varía para cada combustible.
- Gunte: Este diagrama es válido para el estudio de la combustión completa y es aplicable a todo tipo de combustibles
- Ostwald: Este diagrama es válido para combustiones incompletas, con inquemado formados solamente por CO (no se forman por tanto hollines). Este tipo de diagramas da buen resultado para índices de exceso de aire elevados.
- Keller: Es válido para combustiones incompletas. Tenemos además de CO y H2, los inquemados. Es válido para combustibles con alto contenido en H2 y relación C/H2 baja. Es válido cuando el índice de exceso de aire es bajo.