La facilidad con la que se puede separar un electrón de un átomo se mide por su energía de ionización, que se define como la energía mínima necesaria para separar un electrón del átomo en fase gaseosa:
A(g) → A+(g) + e-(g) ΔH = I1
La primera energía de ionización, I1, es la que se requiere para arrancar el electrón más débilmente unido al átomo neutro en estado gaseoso; la segunda energía de ionización, I2, corresponde a la ionización del catión resultante, y así sucesivamente. Las energías de ionización se expresan en electrones-voltios (eV), donde 1 eV es la energía que adquiere un electrón cuando atraviesa una diferencia de potencial de 1V. 1eV equivale a 96,487 kJ mol-1.
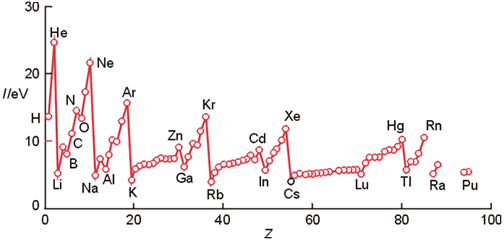
Variación de la 1ª energía de ionización con el número atómico.
La energía de ionización del hidrógeno es de 13.6 eV. Las primeras energías de ionización varían sistemáticamente a lo largo de la Tabla Periódica, como se aprecia en la Figura 9. La variación de esta propiedad atómica es la misma que sigue la carga nuclear efectiva, esto es, aumenta al lo largo de un periodo y disminuye al descender en un grupo. Las energías de ionización también se pueden correlacionar con el radio atómico, de manera que elementos que tienen pequeños radios atómicos generalmente poseen elevadas energías de ionización. La explicación de esta correlación radica en el hecho de que en los átomos pequeños los electrones están más próximos al núcleo y experimentan una mayor fuerza de atracción de tipo coulombiana.
No obstante, en la Figura 9 se puede observar la existencia de excepciones a esta tendencia periódica. Por ejemplo, la primera energía de ionización del B es más pequeña que la del Be a pesar de que para el primero el valor de Zef es mayor. Esta anomalía puede explicarse atendiendo a las configuraciones electrónicas de ambos elementos. Al pasar del Be al B el electrón diferenciador pasa a ocupar uno de los orbitales 2p y en consecuencia se encuentra más débilmente unido al átomo que si, por ejemplo, ocupara un orbital de tipo 2s. En consecuencia, I1 disminuye al pasar de un elemento al otro. Otra anomalía se presenta entre el nitrógeno y el oxígeno. La explicación a este efecto es algo distinta a la anterior. Las configuraciones electrónicas de ambos átomos son las siguientes:
7N: 1s22s22p38O:1s22s22p4
Como puede observarse para el átomo de oxígeno existen 2 electrones ocupando un mismo orbital 2p. Estos electrones experimentan una fuerte repulsión entre ellos, efecto que llega a compensar el aumento de la carga nuclear efectiva al pasar del N al O. Otra contribución importante a la menor energía de ionización del O es el hecho de que la configuración electrónica del catión O+: 1s22s22p3 es de tipo semillena, que supone un incremento adicional de estabilidad.
Es importante hacer notar que las sucesivas ionizaciones de una especie química requieren cada vez una energía mayor. Así, la segunda energía de ionización de un elemento (energía necesaria para quitar un electrón al catión A+) es mayor que la primera, mientras que la tercera energía de ionización es todavía mucho mayor. Esto se debe a que cuanto mayor sea la carga positiva de una especie mayor es la energía que se necesita para arrancar un electrón de la misma. Esta diferencia en las sucesivas energías de ionización es muy apreciable cuando el electrón que se elimina pertenece a una configuración interna o de capa cerrada, como ocurre, por ejemplo, con las segundas energías de ionización de los elementos alcalinos. Así para el Li, I1 es 5,3 eV pero I2 es de 75,6 eV, más de 10 veces mayor.
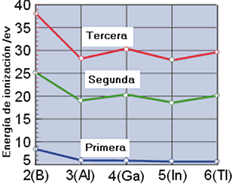
I1,I2,I3 para los grupos 13-15
Los valores de las sucesivas ionizaciones no suelen presentar tendencias similares. La figura anterior muestra los valores de las tres primeras energías de ionización para los elementos del grupo 13. Aunque para cada elemento se cumple que I1 < I2 < I3, dentro de cada energía no se observa un mismo comportamiento.
Una visión más detallada de los valores de las energías de ionización de los elementos permite resaltar ciertos comportamientos singulares. Uno de ello está relacionada con la gran energía que se requiere para generar los cationes tri y tetravalentes A3+ y A4+ en los elementos del bloque p del periodo 6, en comparación con los correspondientes del periodo 5, y más concretamente entre Tl y Pb comparados con In y Sn. Así, los compuestos de Tl+ son mucho más numerosos que los de Tl3+, y éstos se convierten fácilmente en aquellos. Algo similar ocurre con Pb2+ y Pb4+, siendo el primero mucho más frecuente que el segundo. En términos clásicos este hecho se ha atribuido al denominado efecto del par-inerte, que supone que los dos electrones de la capa s correspondiente son más difíciles de arrancar y de ahí la gran energía necesaria para la ionización tri o tetravalente.