El formato moderno de la Tabla Periódica es un reflejo de la estructura electrónica de los elementos que la forman. Es posible ver, por ejemplo, que los bloques en los que se puede dividir la tabla indican el tipo de subcapa que está ocupándose de acuerdo con el principio de construcción. Cada periodo de la Tabla corresponde al llenado completo de las distintas subcapas que componen una capa dada. El número del periodo corresponde al valor del número cuántico principal n de la capa que se está llenando. El número de los grupos está relacionado estrechamente con el número de los electrones de la capa de valencia (capa más externa) del átomo. No obstante la relación depende del número del grupo y del sistema de numeración actual recomendado por la IUPAC según el cual los grupos se numeran del 1 al 18.
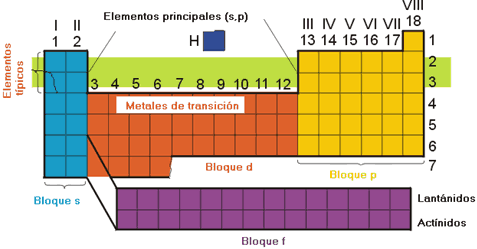
La Tabla Periódica moderna.
| Bloque | Número de e- de la capa de valencia |
|---|---|
| s,d | G (número del grupo) |
| p | G-10 |
Los bloques que constituyen la Tabla Periódica son los siguientes:
- Bloque s: formado por los elementos de los grupos 1 y 2 (alcalinos y alcalinotérreos). Se caracterizan por ser metales ligeros y tener una configuración de la capa de valencia del tipo ns1 o ns2.
- Bloque d: constituido por los elementos de los grupos 3-12. Son los denominados metales de transición. La característica principal de este grupo es el llenado de los orbitales d.
- Bloque f: constituido por los elementos lantánidos y actínidos. La característica principal de este grupo es el llenado de los orbitales f.
- Bloque p: constituido por los metales de post-transición y los no metales. Comprende los elementos de los grupos 13 al 18. Estos elementos se caracterizan por el llenado de las subcapas p.
Reglas de Slater
Cálculo de la carga nuclear efectiva
Una vez conocidas las configuraciones electrónicas, resulta conveniente repasar las Reglas de Slater para el cálculo de las cargas nucleares efectivas que soportan los electrones en un átomo. Aunque los valores de la tabla de de carga nuclear efectiva son los que se emplean de forma sistemática, el conocimiento de estas Reglas empíricas permite racionalizar gran parte de las propiedades periódicas que se estudiaran a continuación. Así, la carga nuclear efectiva Zef = Z - s se calcula a partir de Z (número atómico) y de la constante de apantallamiento o constante de Slater s. Para calcular de forma aproximada el valor de s no hay más que seguir los siguientes pasos:
Para un electrón de un orbital ns o np.
- Escribir la configuración electrónica de la siguiente forma, respectando las agrupaciones que se indican:
- (1s) (2s,2p) (3s,3p) (3d) (4s,4p) (4d) (4f) (5s,5p), (5d) (5f) (6s,6p) (6d) ...
- Todos los electrones a la derecha del grupo (ns,np) no contribuyen a la constante de apantallamiento.
- Todos los demás electrones en el grupo (ns,np) contribuyen a s con 0.35 unidades cada uno.
- Todos los electrones del nivel n-1 contribuyen con 0.85 unidades cada uno.
- Todos los electrones de los niveles n-2 e inferiores contribuyen con una unidad cada uno.
Así, para el caso de un electrón de valencia en el átomo de nitrógeno, 7N, de configuración electrónica 1s2 (2s2p)5, el valor de la carga nuclear efectiva se calcula del siguiente modo:
σ = 2 x 0.85 + 4 x 0.35 = 3.1
Zef = Z - σ = 7 – 3.1 = 3.9
Para un electrón de un orbital nd o nf.
- Todos los electrones a la derecha del grupo (nd) o (nf) no contribuyen a la constante de apantallamiento
- Todos los demás electrones en el grupo (nd) o (nf) contribuyen a s con 0.35 unidades cada uno.
- Todos los electrones a la izquierda del grupo (nd) o (nf) contribuyen con una unidad.
Considérese ahora el caso de un electrón de valencia 4s del 30Zn. Su configuración electrónica, agrupada como se indica, es la siguiente:
(1s)2 (2s,2p)8 (3s,3p)8 (3d)10 (4s,4p)2
σ = 10 x 1 + 18 x 0.85 + 1 x 0.35 = 25.65
Zef = Z - σ = 30 – 25.65 = 4.35
Para el caso de un electrón 3d:
σ = 18 x 1 + 9 x 0.35 = 21.15
Zef = Z - σ = 30 – 21.15 = 8.85
Propiedades periódicas
Ciertas propiedades características de los átomos, en particular el tamaño y las energías asociadas con la eliminación o adición de electrones, varían periódicamente con el número atómico. Estas propiedades atómicas son de importancia para poder explicar las propiedades químicas de los elementos. El conocimiento de la variación de estas propiedades permite al químico poder racionalizar las observaciones y predecir un comportamiento químico o estructural determinado sin tener que recurrir a los datos tabulados para cada uno de los elementos. Las propiedades periódicas que se van a considerar son:
- Radio atómico y radio iónico.
- Energía de ionización.
- Afinidad electrónica.
- Electronegatividad.
- Polarizabilidad.