Una de las propiedades atómicas más utilizadas de un elemento es el tamaño de sus átomos e iones, pues de ella dependen las estructuras de muchos sólidos y moléculas individuales y otras propiedades periódicas como la energía de ionización de los electrones.
La teoría cuántica del átomo no proporciona un valor preciso del radio atómico o iónico porque a distancias grandes la función de onda de los electrones cae exponencialmente con la distancia al núcleo. Sin embargo, a pesar de la falta de un radio preciso o exacto, se espera que los átomos con un gran número de electrones sean más grandes que los átomos que poseen menos electrones. Estas consideraciones han llevado a los químicos a proponer varias definiciones del radio atómico basadas en consideraciones empíricas
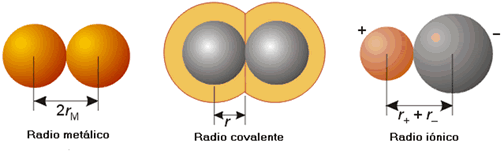
Radio metálico, radio covalente y radio iónico.
Se
define el radio metálico de un elemento metálico como la mitad de la
distancia, determinada experimentalmente, entre los núcleos de átomos vecinos
del sólido. El radio covalente de un elemento no metálico se define, de
forma similar, como la mitad de la separación internuclear de átomos vecinos
del mismo elemento en la molécula. En adelante la referencia a radios metálicos
o covalentes será sinónima de radios atómicos. El radio iónico de un elemento
está relacionado con la distancia entre los núcleos de los cationes y aniones
vecinos. Para repartir esta distancia hay que tomar un valor de referencia, que
es el radio iónico del anión oxo, O2-, con 1.40 Å. A partir de este
dato se pueden construir tablas con los radios iónicos de los distintos
cationes y aniones.
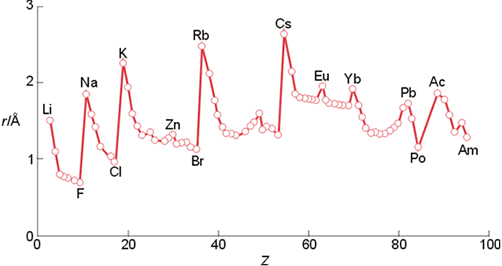
Variación del radio atómico con el número atómico.
La Figura 8 muestra la variación del radio atómico a lo largo de la Tabla Periódica. El radio atómico aumenta al descender en un grupo y para los elementos de los grupos s y p el radio atómico disminuye de izquierda a derecha en un periodo. Esta variación puede interpretarse atendiendo a la configuración electrónica de los átomos. Al descender en un grupo, aumenta el número cuántico principal, y al pasar de un periodo a otro los electrones de valencia ocupan orbitales de número cuántico superior al anterior. Como se puede comprobar en las gráficas de las funciones de onda radial, los máximos se encuentra cada vez mas alejados del núcleo conforme aumenta n, lo que explica el aumento en el tamaño del átomo. Por el contrario, a lo largo de un periodo los electrones de valencia ocupan orbitales con el mismo valor de n). Los valores de la carga nuclear efectiva a lo largo de un periodo aumentan (véanse por ejemplo los de los electrones 2p desde el B al Ne, Tabla 1), que hace que los electrones externos estén cada vez más atraídos que los del elemento que le precede en la Tabla Periódica. Ello supone que en un periodo los átomos se hacen cada vez más compactos, esto es, cada vez más pequeños.
El periodo 6 (Cs-Po) muestra una interesante e importante modificación de estas tendencias. Como puede observarse en la figura anterior, el radio metálico de los elementos de la tercera serie de transición es muy similar a los que muestran los metales de la segunda serie de transición y no significativamente mayores como en un principio cabría esperar. Por ejemplo, el radio del Mo es de 1,40 Å y el del W es sólo de 1,41 Å, a pesar de que este último elemento tiene 32 electrones más que el primero. Este efecto en la reducción del radio atómico para estos elementos se conoce como la contracción lantánida. El nombre del efecto apunta directamente a la causa del mismo. Los elementos del periodo 6 están precedidos por los elementos de la serie lantánida en los cuales se ocupan los orbitales 4f. Estos orbitales tienen muy poca capacidad de apantallamiento, de manera que las repulsiones entre los electrones que se van añadiendo a lo largo de la serie f no compensan el aumento de la carga nuclear y, en consecuencia, Zef aumenta de izquierda a derecha a lo largo del periodo; el efecto dominante de Zef hace que los electrones estén fuertemente atraídos y los átomos sean más compactos.Una contracción similar se encuentra en los elementos que siguen a los de las series d. Por ejemplo, aunque existe un importante aumento del radio atómico al pasar del B al Al (de 0,88 Å a 1,43 Å), el radio atómico del Ga (1,53 Å) es sólo ligeramente mayor que el del Al. Como ocurre en la contracción lantánida, este pequeño aumento observado en el radio atómico del Ga se debe al pobre efecto de pantalla de los electrones d de los elementos que se encuentran a la izquierda del Ga. Aunque estas diferencias en los radios atómicos parecen ser pequeñas y de poca importancia lo cierto es que estos cambios tienen profundas consecuencias en las propiedades químicas de los elementos.
Una última característica que merece mencionarse en este apartado es la comparación entre los volúmenes de cationes y aniones de un mismo elemento. De forma general, los aniones suelen ser más voluminosos que los átomos de los que proceden, mientras que los cationes suelen presentar un volumen menor que dichos átomos. En el primer caso, un anión incorpora un electrón que va a generar mayores repulsiones interelectrónicas, sin que haya habido un aumento en la carga nuclear que lo compense, al menos parcialmente. Ello deriva en una expansión de la nube electrónica para minimizar aquellas repulsiones. En el caso del catión se produce el efecto contrario. La pérdida de carga negativa supone una disminución de tales repulsiones, y el excedente de carga positiva nuclear conduce a un volumen más compacto. Hechas estas observaciones, la variación de radios iónicos (positivos y negativos) a lo largo de la Tabla Periódica es similar a la de los radios atómicos ya comentada.