Estudios de difracción de rayos X han permitido determinar la estructura de muchos elementos metálicos, revelando la existencia de empaquetamientos compactos en muchos de ellos. Ello indica que presenta una débil tendencia a formar en esas estructuras enlaces covalentes dirigidos. Una consecuencia del compactación es la alta densidad de dichos metales, ya que existe una gran cantidad de masa en un volumen mínimo. La Tabla 1 muestra las estructura cristalinas que presentan algunos metales en condiciones suaves.
Tabla 1. Estructuras cristalinas de elementos metálicos a 25ºC y 1atm
Estructura cristalina |
Elemento |
|---|---|
Hexagonal compacta |
Be, Cd, Co, Mg, Ti, Zn |
Cúbica compacta |
Ag, Al, Au, Ca, Cu, Ni, Pb,
Pt |
Cúbica centrada en el cuerpo |
Ba, Cr, Fe, W, alcalinos |
Cúbica-primitiva |
Po |
En la Tabla aparecen dos estructuras no comentadas hasta ahora: la cúbica centrada en el cuerpo y la cúbica primitiva. Estas son dos estructuras menos compactas que las dos anteriores. La estructura cúbica centrada en el cuerpo presenta como celda unidad un cubo formado por ocho esferas con una novena esfera en el centro del cubo (Figura 5). Los metales con esta estructura presentan, obviamente, un número de coordinación ocho. Una estructura aún menos frecuente es la cúbica primitiva, cuya celda unidad coincide con la anterior exceptuando la esfera del centro del cubo. El número de coordinación en esta estructura es seis, y tan sólo la presenta el Po a presión y temperatura ambientes. Con estas cuatro estructuras se pueden explicar la inmensa mayoría de las estructuras que presentan los metales, pues en muchos casos las estructuras reales son mezclas de las mismas.
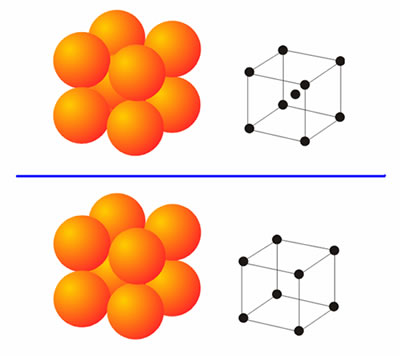
Figura 5. Arriba, estructura cúbica centrada en el cuerpo. Abajo, estructura cúbica-primitiva.
El polimorfismo de los metales.
Se define polimorfismo como la capacidad de adoptar distintas formas cristalinas, bajo distintas condiciones de presión y temperatura. Así, por ejemplo, el hierro presenta distintas transiciones en fase sólida conforme se va calentando. Una característica general es que las fases más compactas suelen ser las termodinámicamente más favorables a temperaturas bajas, mientras que las menos compactas lo serán a altas temperaturas.
Los polimorfos de los metales se suelen denominar (con excepciones) con las letras griegas a, b, g... conforme aumenta la temperatura. Incluso algunos metales revierten a la forma estable a baja temperatura cuando alcanzan temperaturas más altas. El hierro presenta las siguientes transiciones: a-Fe (cúbico centrado en cuerpo) es estable hasta 906 ºC, cuando se convierte en g-Fe(cúbico compacto), el cual a su vez retorna a a-Fe a los 1401 ºC, y se mantiene en esta forma hasta que funde a los 1530 ºC. La forma b (hexagonal compacta) aparece bajo alta presión. Otro ejemplo de polimorfismo es el del estaño. A temperatura ambiente el polimorfo estable es el estaño blanco b-Sn, que se convierte en estaño gris, a-Sn, por debajo de 14.2 ºC.
Los radios atómicos de los metales.
En un capítulo anterior se ha definido el radio metálico como la distancia entre los centros de dos átomos vecinos. Sin embargo, ahora es ya posible adivinar que tales distancias no van a ser iguales a lo largo del cristal, y un mismo elemento que presente dos estructuras distintas presentaría radios metálicos distintos. Un extenso estudio sobre las distancias internucleares en un amplio número de elementos polimórfico permitió a Goldschmidt proponer un método para calcular el radio metálico promedio en función del número de coordinación (Tabla 2).
Tabla 2. La variación del radio con el nº de coordinación
nº Coordinación |
Radio relativo |
12 |
1 |
8 |
0.97 |
6 |
0.96 |
4 |
0.88 |
Generalmente se suele ajustar la separación internuclear hallada experimentalmente a una geometría de empaquetamiento compacto, es decir, aquella con número de coordinación 12. Por ejemplo, el radio atómico del sodio es 1.85 Å, pero ese valor corresponde a una estructura con número de coordinación de 8. Para ajustarlo a N.C. = 12 se multiplica ese radio por 1/0.97 = 1.03, de donde se obtiene el valor de 1.91 Å. De hecho, los valores que se mostraron en el capítulo correspondiente estaban referidos a esta situación de número de coordinación 12.