W. Latimer ideó este tipo de diagrama, bastante simple, donde el valor del potencial normal (en voltios) se escribe sobre una línea recta que conecta especies de un elemento en distintos estados de oxidación. La forma más oxidada del elemento se escribe en la parte izquierda, y hacia la derecha, aparecen, sucesivamente los estados de oxidación inferiores. Por ejemplo, considérese el diagrama de Latimer para el cloro en disolución ácida:
![]()
La
notación: ![]()
se refiere a la semirreacción:
ClO4- (ac) + 2H+ (ac) + 2e- → ClO3- (ac) + H2O (l)...........Eº = +1.20 V
De esta manera, la conversión del diagrama de Latimer en una semirreacción implica su ajuste, incluyendo las especies presentes en la disolución acuosa ácida (H+ y H2O).
En disolución básica, el diagrama de Latimer para el cloro es el siguiente:
![]()
Como se observa el valor del para Cl2/Cl- es el mismo que en disolución ácida, dado que en su semirreacción no participan los protones:
½ Cl2 (g) + 1e- → Cl- (ac) ...........Eº = +1.36 V
La semirreacción desarrollada correspondiente al par ClO-/Cl2 en medio básico queda de la forma siguiente
2ClO- (ac) + 2H2O (l) + 2e- ® Cl2 (ac) + 4OH- (ac)...........Eº = +0.42 V
Los diagramas de Latimer contienen suficiente información como para poder deducir los potenciales normales de pares no contiguos. Para ello se hace uso de la siguiente expresión:
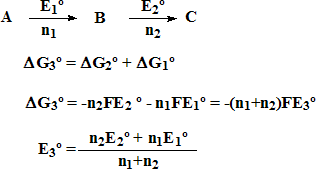
Ejercicio: utilizar el diagrama de Latimer del cloro en disolución ácida para calcular el valor de Eº para la reducción del HClO a Cl-:
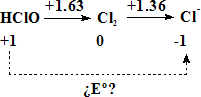
1er paso:
![]()
E1º = +1.63 V, n1 = 1
2º paso:![]()
E2º = +1.36 V, n2 = 1
Eº(HClO/Cl-) = (1.63 + 1.36)/ 2 =1.50 V
El diagrama de Latimer muestra también las especies para las cuales la desproporción es espontánea: “una especie tiende a desproporcionarse espontáneamente si el potencial a la derecha de la especie es mayor que el que se encuentra a su izquierda”
Si se observa el diagrama de Latimer para el cloro en medio ácido se encuentra lo siguiente:
![]()
El potencial del par Eº(ClO2-/HClO) > Eº(ClO3-/ClO2-), y por lo tanto, la especie ClO2- tiende a desproporcionarse: Se puede demostrar el fundamento de la regla considerando las dos semirreacciones:
ClO3- (ac) + 2H+ (ac) + 2e- → ClO2- (ac) + H2O (l)...........Eº = +1.18 V
ClO2- (ac) + 3H+ (ac) + 2e- → HClO (ac) + H2O (l)...........Eº = +1.65 V
↓
ClO2- (ac) + 3H+ (ac) + 2e- → HClO (ac) + H2O (l)...........Eº = +1.65 V
ClO2- (ac) + H2O (l) → ClO3- (ac) + 2H+ (ac) + 2e-...........Eº = -1.18 V
2ClO2- (ac) + H+ (ac) + 2e- → ClO3- (ac) + HClO (ac).........Eº = + 0.47 V
Eºreac = Eº(ClO2-/HClO) – Eº(ClO3-/ClO2-) = 1.65 – 1.18 = 0.47 V
Eº > 0 => ∆Gº < 0, reacción espontánea