Calores específicos de sólidos
Las medidas de cp para los sólidos revelan que el calor específico a presión constante varía muy poco con la presión, sin embargo, su variación con la temperatura es muy importante.
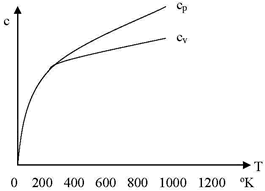
Por ej., representando la variación de cp en función a la temperatura para el cobre, se observa que cuando la temperatura aproxima al 0 absoluto, cp tiende a 0, mientras que al aumentar la temperatura, su valor se eleva en forma continua.
Este comportamiento de cp lo cumplen la mayoría de los metales puros y muchos compuestos, pero hay excepciones. Como se dijo antes, el calor específico a volumen constante cv, es casi imposible de medir, en consecuencia su valor se determina a partir del valor de cp y aplicando ecuaciones que relacionen ambos calores.
Al igual que cp, el calor específico a volumen constante varía muy poco con la presión, pero con la temperatura su variación es notable.
El diagrama para el cobre muestra que a bajas temperaturas cp y cv son casi iguales, mientras que a temperaturas elevadas se diferencian mucho, tendiendo cv a un valor constante.
Otras características de los calores específicos de los sólidos es que los valores son inferiores a 1 cal / gr ºC, salvo el litio para temperaturas superiores a 100 ºC.
Además los cuerpos de mayor peso atómico poseen los menores calores específicos. En el caso de las aleaciones, la capacidad calorífica de la aleación se puede calcular sumando las capacidades caloríficas de sus componentes. Los sólidos cumplen la Ley de Dulong y Petit, que establece que para todos los cuerpos simples el calor atómico es sensiblemente constante e igual aproximadamente a 6,4 cal / at gr ºC.
Calores específicos de líquidos
Al igual que en los sólidos, los calores específicos varían poco en función de la presión pero sí notablemente con respecto a la temperatura. Los valores son en general menores que 1 cal / gr ºC, y a la temperatura de fusión el calor específico de un líquido es mayor que el del sólido a la misma temperatura.
Calores específicos de gases
En los gases, los valores de cp son mayores que los de cv, pues a presión constante el gas se dilata realizando cierto trabajo para vencer la presión exterior, y entonces se necesita absorber una cantidad de energía equivalente a ese trabajo. En los gases se mide generalmente cp directamente y el valor de cv se deduce de las relaciones que lo vinculan con cp.
La medida de cv es imposible realizarla con gran exactitud debido a que la capacidad calorífica de la masa gaseosa que puede contener un recipiente cualquiera es pequeña, o por lo menos del mismo orden que este.
Foco calorífico
Se entiende por foco calorífico a todo cuerpo cuya masa sea tan grande que pueda absorber o ceder una cantidad ilimitada de calor sin experimentar variación apreciable de su temperatura ni de cualquiera otra variable termodinámica. O sea que un foco calorífico posee una capacidad calorífica infinita. Una gran masa de agua como el océano, o de aire como la atmósfera, son ejemplos prácticos de focos caloríficos.
Debe tenerse en cuenta que en la realidad un foco calorífico sufre algún cambio en sus variables termodinámicas al absorber o ceder calor, sin embargo, estos cambios son tan extremadamente pequeños que es imposible medirlos.