Superconductivity and spin orbit of Electron coupling.
Por Heber Gabriel Pico Jiménez MD
Resumen
Este trabajo demuestra que los dos polos que crean el campo magnético del espín en un electrón, son neutralizados en perfecto acoplamiento, por los cabos opuestos del campo magnético que origina otro electrón de espín contrario. Este grado de articulación puede medirse indirectamente en relación al núcleo atómico central, gracias a las características orbitales que ocasiona este respectivo enganche en el movimiento acoplado de ese par de electrones. Interaccionan con tanta fuerza los electrones que en la órbita superan holgadamente a la repulsión que ocasiona el hecho de tener la carga eléctrica del mismo signo, permitiendo así el apareamiento. Encaje que además de acaecer en el estado basal del átomo neutro, ocurre en las formas alotrópicas y en los portadores de carga eléctrica que son siempre pares de electrones ajustados. Esta coyuntura es entonces una propiedad intrínseca que además de establecer el grado de arreglo espín-órbita, es una cualidad de variación periódica que contribuye tanto al valor de la energía del electrón como a la calidad del apareamiento que tendrían un par de electrones en un orbital ya sea basal o molecular y que en base a él, aparecen las distintas propiedades eléctricas quien además de definir la electronegatividad, la afinidadelectrónica y la energía de ionización, revelan mecanismos precisos que explican a las presentaciones alotrópicas, a los orbitales moleculares, a través de la densidad de carga eléctrica explican al efecto isotópico, a la superconductividad y a las distintas anomalías presentes en la secuencia atómica de la carta periódica por ejemplo, el apareamiento electrónico basal no alotrópico explica el intenso valor relativo que pretende la primera energía de ionización en los grupos 2, 12, 14, 16, 18 y por apareamiento alotrópico solo lo hace la gran primera energía de ionización del grupo 15, a la vez es la misma fuente que origina a los regios decaimientos pretendidos en sus respectivas afinidades electrónicas. Lo contrario ahora, el desapareamiento electrónico basal no alotrópico es la causa del gran decaimiento relativo que tiene la primera energía de ionización en los grupos 1, 6, 11, 13, 15 y 17 y a la vez es la misma razón que origina el incremento pretendido en la afinidad electrónica de esos mismos grupos. El efecto predominante de un ángulo cuántico de espín, explica la mayor afinidad electrónica del cloro frente al flúor. Explica el porqué el paladio pertenece al quinto período de la tabla periódica. Explica el porqué el grafito casi siempre tiende a configurar estructuras alotrópicas cilíndricas y esféricas. No basta con solo decir que un par de electrones están apareados, es necesario establecer el grado relativo del respectivo apareamiento creado por ellos, definir la medida y decir si es un apareamiento es basal o si es simplemente un apareamiento alotrópico.
Palabras claves: Superconductividad, Efecto Isotópico, Densidad Eléctrica, Par de Cooper.
Abstract
This work shows that the magnetic field that causes the intrinsic angular momentum of spin in an electron is saturated and perfectly mated with much impetus by the magnetic field that originates an electron with opposite spin. This degree of coupling can be indirectly measured thanks to the characteristics that link, originating in the respective orbital movement of the electron with respect to the atomic nucleus. Interact so the electrons so strongly that they are even able to overcome loosely in the orbit of the repulsion which originates the fact of having the same sign electric charge, thus enabling the mating. Coupling is not exclusive to low temperatures. This mesh is then an intrinsic property which in addition to establishing the degree of coupling spectroscopy, is a property of periodic variation that contributes to both the value of the energy of the electron and the quality of mating that would have a pair of electrons in an orbital either basal or molecular and appearing various electrical properties based on it, who in addition to influencing the electronegativitythe electron affinity and ionization energy, revelan mecanismos precisos que explican a las respectivas alotropías, a los mismos orbitales moleculares y a las distintas anomalías presentes en la secuencia atómica de la carta periódica por ejemplo, el apareamiento electrónico basal no alotrópico explica el intenso valor relativo que pretende la primera energía de ionización en los grupos 2, 12, 14, 16, 18 y por apareamiento alotrópico solo lo hace la gran primera energía de ionización del grupo 15, a la vez es la misma fuente que origina a los regios decaimientos pretendidos en sus respectivas afinidades electrónicas. Lo contrary, the basal electronic decoupling not allotropic is now the cause of large relative decay that has the first ionization energy in groups 1, 6, 11, 13, 15 and 17 and at the same time is the same reason that originates the increase sought in the electron affinity of the groups. The predominant effect of a quantum spin angle, explains the greater electron affinity of chlorine against fluorine. Explains why Palladium belongs to the fifth period of the periodic table. Explains why the graphite almost always tends to configure allotropic cylindrical and spherical structures. Is not enough to just say that a pair of electrons are paired, it is necessary to establish the relative degree of the respective mating created by them, define the measure and say if it is a mating is basal or is simply an allotropic mating.
Keywords: Superconductivity, Isotope Effect, Power Density, Cooper Pair.
1. Introducción
Iniciamos la introducción de este artículo precisando que todo su desarrollo estará siempre sostenido en los principios del anterior trabajo de la energía atómica Número cuántico magnético del electrón.
Además es preciso decir que este trabajo anterior del número cuántico está basado en que a pesar de que el movimiento del electrón representa globalmente una trayectoria circular o elíptica alrededor del núcleo atómico, el momento angular intrínseco o espín del mismo electrón, describe siempre en su desplazamiento un ángulo cuántico construido en torno al respectivo núcleo atómico, ángulo cuántico que por resonancia magnética representa a una propiedad intrínseca de la relación que existe entre el espín del electrón y el orbital del mismo, ángulo θ que si se configura agudo con respecto al núcleo para los electrones con determinado espín de un orbital, pues sería suplementario y obtuso de 180-θ para los electrones de la misma energía pero con espines contrarios y en el mismo orbital.
A pesar de que globalmente el electrón describe trayectorias circulares o elípticas según sea el subnivel alrededor del núcleo atómico, su momento angular cumple esa trayectoria pero configurando con respecto al núcleo atómico, distintos ángulos cuánticos de espín.
El orden en el valor de los ángulos cuánticos de espín en la tabla periódica, es que se incrementan de arriba hacia abajo y de izquierda a derecha.
Es tan evidente el hecho de que el ángulo cuántico es una propiedad intrínseca que describe la relación espín-orbita que a medida que el ángulo cuántico se incrementa al ascender el electrón de niveles, los espines contrarios de los electrones están más ligados y están más cercas y más apareados, constituyendo así un par de Cooper más compacto, más unido, más ligado.
El ángulo cuántico de espín es una medida que influye tanto en la cantidad de energía del electrón y el grado de acoplamiento o apareamiento que une a un par de electrones en un orbital cualquiera.
Este trabajo anterior propone una ecuación con quien se calcula la más alta energía de un electrón que permanece ubicado en un orbital electrónico existente, en cualquier nivel atómico, valor que dependería de la relación creada entre los cuatro números cuánticos y el ángulo cuántico descrito por los espines en el momento angular del electrón. Es interesante la circunstancia de que el número de electrones de los niveles de energías incluso el ultimo nivel, es exactamente el mismo número de estados disponibles en la banda electrónica y después incluso, después del último nivel de energía se presenta siempre una banda prohibida o bandgap, ubicada también por encima de la banda de valencia donde no hay estados electrónicos disponibles por lo tanto, al aplicar un campo eléctrico externo los electrones no podrían incrementar su energía y permanecer en el átomo moviéndose más rápido de lo que ya vienen haciéndolo, porque no hay estados electrónicos disponibles donde poder subsistir en movimiento dentro del respectivo átomo. Las anchuras y potencias de esas distintas bandas prohibidas pueden ser de diferentes tamaños y depende de varios factores entre ellos está de si el nivel está lleno o no, depende también de si los electrones se encuentran en el orbital por pares libres o no, depende también del grado de apareamiento entre electrones ya apareados que lo mide el ángulo cuántico de espín y otro es el tipo de subnivel de energía porque no todos ellos configuran un bandgap suficientemente y fuerte. El subnivel s es subnivel que alcanza a configurar el bandgap más contundente y más fuerte que el configurado por el subnivel p y el perteneciente a este último, es de mayor envergadura que el del subnivel d y así sucesivamente. Esta es la razón del gran tamaño que tienen las bandas prohibidas existentes después del último nivel de energía en los gases nobles y además el bandgap existente entre los niveles llenos de energía casualmente porque los pares del último nivel están completos. En el Helio a pesar de tener tan poca masa, tiene una gran carga nuclear efectiva, basta con un solo par de electrones s apareados, precisamente también cuenta con un gran ángulo cuántico de espín que es el más grande del período que los compacta, para saturar el único nivel de energía con un bandgap suficiente. Desde el Neón hasta el átomo sintético de Ununoctio, necesitan configurar bandgap que es distinto. Habrá siempre bandgap entre el primer y segundo nivel de energía que sería el más potente, existirá también entre el segundo y tercer nivel de energía de menor potencia que el anterior, entre el 3º y 4º nivel más débil aun que el anterior, así sucesivamente irán por niveles configurándose bandgap de menor intensidad. El bandgap del helio será el de mayor potencia de todos los bandgap aunque el ángulo cuántico de espín allí sea regular, le seguirá en potencia el del neón, a este le seguiría el del argón y así sucesivamente aparecerán las configuraciones de bandgap menos intensas hasta llegar al bandgap de la valencia.
En este artículo aclaramos que el concepto de banda prohibida o bandgap, es más o menos algo parecido a la noción aplicada por la física del estado sólido a los semiconductores y aislantes, más no esperamos que esta intuición se confunda con el concepto de energía de enlace Δ entre los dos electrones o banda prohibida superconductora.
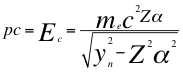 (1)
(1)
Donde p es la cantidad de movimiento del electrón, Ec es la energía cinética del electrón, mees la masa del electrón, Z es el número atómico, α es la constante de estructura fina, ynes la relación entre n y el ángulo θ descrito por la cantidad de movimiento y el radio de la órbita del electrón y C es la velocidad de la luz en el vacío.
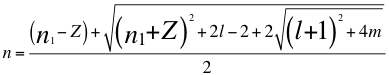 (3)
(3)
Donde n es un número no entero, n1es el número cuántico principal, Z es el número atómico, l es el segundo número cuántico y m es el tercer número cuántico o número cuántico magnético.
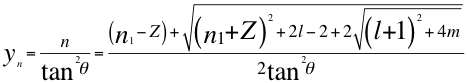 (3)
(3)
Donde ynes la relación entre n y el ángulo θ descrito por la cantidad de movimiento y el radio de la órbita del electrón siendo n un número no entero, n1 es el número cuántico principal, l es el segundo número cuántico y m es el tercer número cuántico o número cuántico magnético.
2. Desarrollo del Tema.
Esta anterior relación número uno (1) que define a la cantidad de energía cinética que tiene un electrón orbitando en el átomo, según se observa depende de dos variables, una es el valor de yn y la otra es Z, el número atómico.
A simple vista se percibe en la anterior relación número uno (1) se puede establecer que es una relación que tiene implícito los efectos relativistas. Vale la pena decir que en la relación se hace notar que a excepción del número atómico en parte, las otras cuatro variables tienen exclusivos efectos relativistas, ellos son los 3 números cuánticos n1, l, m, el ángulo cuántico de espín y nuevamente Z aun.
Si esa anterior relación número uno (1) se la aplicamos a los elementos de una columna, pertenecientes a un mismo grupo de la tabla periódica, barriendo de arriba hacia abajo y estudiando unas veces a los últimos subniveles s del último nivel de energía del grupo I y II, a los últimos subniveles f, d y s de los elementos de transición y el ultimo nivel de los elementos del bloque p. Vemos que a medida que descendemos en un mismo grupo, también se va incrementando Z y además el número cuántico principal n1 en yn por lo tanto a pesar de que se va incrementando el ángulo cuántico de espín y la cantidad de energía de los electrones del último subnivel, también se va incrementando en mayor proporción el efecto pantalla luego, a medida que descendemos en el grupo, pues la carga nuclear efectiva es menor en el último subnivel del último nivel. Pues la primera energía de ionización que es un fenómeno propio del último subnivel, generalmente decrece de arriba hacia abajo debido a que los electrones en los subniveles del último nivel a medida que descienden sienten menor carga nuclear efectiva aunque tengan mayor ángulo cuántico de espín sin embargo, el ultimo subnivel de energía a medida que se va bajando en el grupo poseen mayor cantidad de energía como lo demuestra su reactividad que si se incrementa, vemos como el sodio es mas reactivo que el litio y el bario más reactivo que el berilio por ejemplo. El ultimo nivel energético de los elementos de transición que estaría conformado por los subniveles d, s en unas ocasiones y f, d, s en otras, no se comporta de forma distinta. Además todo el grupo estará caracterizado siempre de manera uniforme, por el estado basal de apareamiento o no del último electrón involucrado en la primera energía de ionización, pues si el último electrón está basalmente apareado con otro electrón en el último subnivel de energía como le sucede al grupo encabezado por el berilio, necesita que le aporten una mayor cantidad de energía para poder basalmente ionizarlo en comparación al hecho de que si el mismo electrón estuviera basalmente no apareado. También debemos tener en cuenta que cuando el ultimo electrón involucrado en la primera energía de ionización, aunque se encuentre basalmente desapareado por lo general, alotrópicamente se intentará aparear para tratar de estabilizar a las distintas presentaciones alotrópicas, cuestión que lo más seguro es que le incremente la razón del aporte de la primera energía de ionización para todos los del grupo como le ocurre a la columna encabezada por el Nitrógeno, por esto la primera energía de ionización del elemento se incrementará y la afinidad electrónica decaerá, dando la sensación de que es un elemento que está basalmente apareado.
Cuando bajamos en un grupo vemos que el primer bandgap toma al primer nivel donde solo se encuentran subniveles s y lo separa del segundo nivel de energía donde además de s también hay subniveles p, lo encontramos en cualquier átomo distinto al hidrogeno, está permanentemente ubicado entre el hidrogeno y el litio o además entre el helio con el neón, es el más intenso y fuerte de todos, yace después del segundo electrón representado por el gaseoso helio. Recordemos la observación de León N. Cooper en que el emparejamiento electrónico, da lugar a una banda prohibida en el espectro continuo de los estados de energía permitida en los electrones, lo cual significa que todas las excitaciones del sistema deben poseer alguna cantidad mínima de energía, ya que pequeñas excitaciones tales como la dispersión de electrones están prohibidas.
El segundo bandgap de menor intensidad que el anterior pero con mayor intensidad que el siguiente bandgap, está separando al segundo nivel donde solo existen subniveles s y p, del tercer nivel de energía del átomo donde también solo existen subniveles s y p, también es permanente y separa al litio del sodio y por orbitales llenos al neón y argón, aparece después del orbital p en el décimo electrón y es representado por el gas noble neón.
El tercer bandgap que coge al tercer nivel donde solo existen subniveles s y p, lo separa del cuarto nivel de energía donde aparece el subnivel d que con menor energía que ellos acompañan al s y al p, ubicado también permanentemente después del gas noble Argón, es de menor intensidad que el anterior bandgap pero de mayor ímpetu que el siguiente. Separa tranquilamente al sodio del potasio y al magnesio del calcio de la misma manera como define por orbitales llenos al argón del kriptón. También está presente con suficiente fuerza en los elementos de transición, tanto es que cercena en ellos al tercer nivel de energía, dejando del lado del cuarto nivel a todo el subnivel 3d.
El cuarto bandgap que toma al cuarto nivel que tiene d, s, p y lo separa del quinto nivel de energía quien también tiene en la misma proporción a d, s y p, es de menor intensidad que el anterior pero es de mayor intensidad que el siguiente bandgap, aparece después del Kriptón y trabaja muy bien separando al potasio del rubidio y al calcio del estroncio, en los elementos de transición separar con claridad por ejemplo al escandio del Itrio dejando del lado del quinto nivel de energía a todo el orbital 4d, separa por orbitales llenos al galio del indio y al kriptón del xenón.
Al quinto bandgap que toma al quinto nivel que tiene subniveles d, s, p y lo separa del sexto nivel de energía que tiene al subnivel f acompañando en la misma proporción a los subniveles d, s y p, es un bandgap de menor intensidad que el anterior pero mayor que el siguiente, aparece después del xenón y separa al cesio y al bario del rubidio y el estroncio, continua en los elementos de transición donde deja del lado del sexto nivel a todo el respectivo orbital d del quinto nivel, apareciendo nuevamente encima del talio y del radón.
La sexta bandgap o banda prohibida de menor intensidad que todas hasta ahora, toma al sexto nivel que tiene subniveles f, d, s, p y lo separa totalmente del séptimo nivel de energía que también tiene los mismos subniveles en el átomo y aparece después del Radón. Separa al cesio y al bario del francio y el radio. Los últimos bandgap son muy débiles y permiten incluso que el xenón y hasta el radón reaccionen además de manera espontánea con el flúor.
De los subniveles originales que pertenecen a un mismo nivel de energía, los f son los de mayor energía que los subniveles d y estos a la vez, aventajan al subnivel p, cuando este mismo subnivel tiene mayor valor energético que el s, pero en los niveles energéticos de los elementos, este orden electrónico no hace su aparición de manera secuencial por ejemplo, el subnivel d aparece ya en el cuarto nivel de energía y lo hace, con menor valor energético que el respectivo subnivel s del propio cuarto nivel de energía. El subnivel f solo se vislumbra en el quinto nivel de energía y lo hace, con menor valor energético que el mismo subnivel d quien a la vez, tiene inclusive menor energía que el mismo subnivel s del respectivo quinto nivel de energía.
1º.-Nivel de energía máximo con 2 electrones.
2º.-Nivel de energía máximo con 8 electrones.
3º.-Nivel de energía máximo con 8 electrones.
4º.-Nivel de energía máximo con 18 electrones.
5º.-Nivel de energía máximo con 18 electrones.
6º.-Nivel de energía máximo con 32 electrones.
7º.-Nivel de energía máximo con 32 electrones.
Este reparto electrónico anterior explica del porqué el paladio, pertenece al quinto período de la tabla periódica.
Desde el cuarto, quinto, sexto y etc niveles de energía aparecen los subniveles f o d de electrones, que a pesar de estar ubicados en el último nivel de energía, si son d tienen menor energía que los propios electrones del propio subnivel s del respectivo último nivel de energía y si son f tienen incluso menor energía que los propios subniveles d como sucede en el sexto nivel de energía, mientras allí mismo se viene llenando un subnivel d que tiene menor energía que el propio 6s. Se puede afirmar que en todos los elementos existe bandgap ubicado entre los distintos niveles de energía pero, desde el cuarto nivel de energía en adelante el último nivel, no solo está compuesto por subniveles s y/o p en el ultimo nivel como le sucede a los primeros 18 elementos de la tabla periódica. Desde el cuarto nivel de energía el último nivel estará conformado por 3 o 4 subniveles, d, s y p que se vienen llenando tal como sucede en los elementos del cuarto y quinto nivele y f, d, s y p en los elementos del quinto y sexto nivel de energía. Inclusive en los elementos del bloque p, siguen presentes en el último nivel pero totalmente llenos.
Presentamos como ejemplo al plomo Pb, elemento que a pesar de no ser de transición precisamente en el sexto (6º) y último nivel n de energía, tiene presente a los cuatro primeros subniveles de energía de la siguiente manera: (n-2)f, (n-1)d, ns y np. La única diferencia que tiene el átomo dePb, con los respectivos elementos de transición ubicados en el mismo período de la tabla periódica, es que los subniveles f, d y s como están repletos no son los que se están llenando en el Pb, sino que lo hacen son los subniveles p. La configuración electrónica del último nivel de energía del átomo de plomo es la siguiente: 4f14, 5d10, 6s2, 6p2. Por convención el mayor subnivel f tiene de coeficiente al 4 como su primer número cuántico, número que hace la evidencia matemática de que esos electrones poseen menor energía de la que tienen los electrones del subnivel d, aunque representen electrones de un subnivel de menor envergadura asignada que el mismo f. Igual sucede con la energía de los electrones del subnivel s que poseen mayor energía, que los electrones del subnivel d. Igual le sucede a los electrones del subnivel p, que aunque tienen el mismo coeficiente o su primer número cuántico igual al s, poseen por conveniencia mayor cantidad de energía que los electrones del subnivel s. todos los cuatro subniveles de energía, están ubicados en el ultimo nivel de energía del átomo de plomo.
Si le aplicamos ahora esa anterior relación número uno (1) a los elementos que pertenecen a una misma fila de un período en la tabla periódica, barriendo la carta de izquierda a derecha vemos que ahora así como se incrementaba Z y n1 y el ángulo cuántico de espín en una columna o grupo de la tabla periódica, ahora se incrementa Z y el ángulo cuántico de espín en las mismas filas, también hay al mismo nivel un escalamiento de los subniveles y orbitales identificados como segundo (l) y el tercer número cuántico (m), pues ahora el incremento de la energía orbital del electrón se debe tanto a Z identificada por la carga nuclear efectiva como también el incremento en el valor de los restantes números cuánticos incluyendo al ángulo cuántico de espín, que también sufre incremento y así aumentan los acoples efectivos del apareamiento entre los espines contrarios de los electrones apareados que es más fuerte a la derecha y hacia abajo. Puede observarse fácilmente de manera general, cómo la primera energía de ionización en un mismo nivel sufre incremento de izquierda a derecha al recorrer distintos grupos en el mismo período de la tabla periódica.
Este ángulo cuántico del espín es la justificación del hecho de que a pesar de que el valor de la primera energía de ionización en la tabla periódica, lentamente se va incrementando de izquierda a derecha a medida que aumenta el grupo de la tabla sin embargo, en los elementos del grupo 13 solo la primera energía de ionización es menor en la mayoría de los casos que las del grupo 12 y 2, solo la primera energía de ionización es la que rompe esa secuencia debido a que el primer electrón del bloque p está desapareado y es menos costoso sacarlo, decimos que es solo la primera energía de ionización porque en la segunda y tercera energías de ionización, no sucede lo mismo que sucede con la primera.
En el grupo 15 sobretodo al Nitrógeno, Fósforo y el Arsénico le sucede es lo contrario de lo que le ocurre al grupo 13 del boro, solo la primera energía de ionización es la que se dispara rompiendo el orden secuencial del período, ella se incrementa debido a que el primer electrón, aunque en la configuración atómica basal está desapareado, alotrópicamente como nitrógeno gaseoso molecular, no es así, porque el nitrógeno puro en estado gaseoso mantiene una forma alotrópica constituida por moléculas muy estables de di nitrógeno con tres muy fuertes enlaces entre ellos de los cuales, uno de esos orbitales moleculares está construido por los dos electrones basales antes desapareados, correspondientes a cada uno de los dos átomos de nitrógeno.
El ángulo cuántico de espín también explica la energía involucrada en el fenómeno identificado como Afinidad electrónica. Explica el porqué a pesar de tener la Afinidad electrónica una distribución periódica en la tabla semejante a la electronegatividad y la primera energía de ionización, precisamente son los átomos con electrones impares los grupos seleccionados por la afinidad electrónica y escoge además a elementos como el Au y los halógenos para ostentar los mayores índices y no a los gases nobles por ejemplo.
El ángulo cuántico de espín explica el porqué la Afinidad electrónica es abiertamente mayor en los elementos del grupo uno (1) de la tabla periódica, con respecto a los elementos del grupo dos (2) de la misma tabla.
El ángulo cuántico de espín es una propiedad periódica, atómica y variable quien a través de la calidad de la distribución electrónica, sustenta y explica a la electronegatividad, la Afinidad electrónica y la energía de ionización.
La primera energía de ionización de un electrón apareado basalmente, es mayor que la primera energía de ionización de un electrón totalmente libre en su orbital basal es decir no apareado.
Sin embargo la primera energía de ionización de un electrón apareado alotrópicamente, es mayor que la primera energía de ionización de un electrón molecularmente libre en su presentación alotrópica.
Si dos presentaciones están igualmente apareadas, en este caso el valor del ángulo cuántico de espín, es quien define el valor de la primera energía de ionización que depende, del preciso grado de apareamiento estipulado por el valor del ángulo cuántico de espín.
El ángulo cuántico de espín explica la afinidad electrónica del hidrogeno y la estabilidad del ion hidruro.
Esta anterior relación número uno (1) nos permite describir las cualidades originales que tendrían los electrones de valencia en los respectivos orbitales propios de cada elemento neutro, estados que le permiten conocer los puntos precisos de las condiciones que lo dejan establecer los pasos para conformar los distintos tipos de orbitales moleculares. Es decir unas veces será necesario el aporte externo de energía para ser aptos a conformar los orbitales moleculares y en otras no, pero siempre los orbitales moleculares serán entidades distintas a los orbitales basales de cada elemento solitario en estado neutro.
La afinidad electrónica y la primera energía de ionización dependen sobremanera del estado alotrópico que tiene el elemento, por eso vemos el valor de la primera energía de ionización que tiene el nitrógeno además, contrastado con su afinidad electrónica.
ALOTROPIA
La alotropía es la propiedad que tienen todos los elementos químicos de poseer estructuras químicas distintas de acuerdo al equilibrio interno con las condiciones de temperatura y presión en que se encuentren. La explicación de quien origina las diferentes propiedades alotrópicas, se ha atribuido sin lugar a dudas a la disposición espacial de los átomos pero este artículo considera que eso no es lo más atractivo, lo substancial es además explicar la razón de quién es el que está causando esa distribución espacial, pues en este artículo se atribuyen a las diferentes cualidades y cantidades de energía electrónicas propias de los átomos que a la fuerza, guardan un equilibrio interno tanto con el núcleo atómico como con las condiciones ambientales externas y ese es el punto preciso en el que se quiere concentrar el objetivo de este artículo. Por ese mismo motivo también intentamos describir la estabilidad nuclear de los átomos.
Los primeros elementos con quien tienen la natural oportunidad de reaccionar los átomos es con ellos mismos, por esto es que la alotropía es una de las primeras y más importantes moléculas ya que de acuerdo a su presencia, se desencadenarán las distintas reacciones con otros elementos en las múltiples condiciones atmosféricas.
Al hablar de alotropía, debemos iniciar el tema describiendo a las formas familiares estables de los elementos que primero hallamos en la naturaleza y que se distinguen, porque surgen espontáneamente en medio de las condiciones estándares de presión y temperatura. Debemos tener en cuenta que el resto de presentaciones atómicas ocurren porque de alguna manera, han sido alteradas las condiciones estándares iniciales, inclusive en la forma experimental.
Para constituir orbitales moleculares, la mayoría de la veces es necesario el apareamiento de dos electrones con espines contrarios pero la condición es que posean el mismo ángulo cuántico y la misma cantidad energética, si eso se cumple describirán así trayectorias apareadas circulares, cerradas y dirigidas al lado de los restantes núcleos atómicos de los elementos reactantes, girando en un sentido por lo tanto, la forma más fácil y barata de lograrlo es haciendo las iniciales presentaciones alotrópicas. Sin embargo los orbitales moleculares también podrían estar conformados algunas pocas veces por un electrón solitario y no apareado estableciendo enlaces con deficiencia en el número de electrones, tal como lo hace el boro cuando se conecta a los dos hidrógenos centrales en el Diborano, que son enlaces puentes de electrones tipo bananas. Otro caso donde también se forman orbitales moleculares con deficiente número de electrones y en este caso con un solo electrón, es el caso del catión dihidrogeno o ion molecular dihidrogeno H2+.
ALOTROPIA DEL HIDROGENO
Empezamos refiriéndonos a la descripción de la molécula más simple de la naturaleza que es el dihidrogeno, diciendo que todos los átomos de una molécula por lo menos en su último nivel de energía, los electrones no se encuentran ocupando los mismos sitios que le corresponderían de acuerdo a sus números cuánticos y al valor del ángulo que describen su momento angular si estuviera solito, se ubican es debido al equilibrio que surge entre el momento angular del núcleo, los electrones y la energía del medio ambiente en que están.
El hidrogeno en el universo se encuentra principalmente es en su forma atómica y en estado de plasma, cuyas propiedades son bastante distintas a las del hidrogeno molecular. Como plasma el protón y electrón del hidrogeno no están ligados, por lo que presenta una alta conductividad eléctrica y una gran emisividad pues las partículas cargadas están fuertemente influenciadas por los campos eléctricos y magnéticos, como se explica en las “Corrientes de Birkenland” y el fenómeno de las “Auroras”.
En condiciones estándar el hidrogeno existe como gas diatómico pero es extremadamente poco abundante en la atmosfera de la tierra, ya que apenas se produce se escapa muy fácil del influjo de la gravedad y por lo tanto, abunda más es en el espacio interestelar y por lo tanto, es muy difícil de generar, concentrar y purificar en la tierra. La mayor parte del hidrogeno terrestre se encuentra formando parte de los compuestos químicos.
Decimos que el Protio es el isótopo estable más común del hidrogeno teniendo una abundancia del 99,98% y tiende a perder el electrón en los hidruros no metálicos H+ o a adquirir un par de electrones apareados en los hidruros metálicos H-. En el hidrogeno gaseoso molecular, los núcleos atómicos con su espín se mueven en torno al par electrónico orbital molecular central, constituyen así un estado energético fundamental dividido en estructura hiperfinaque son perturbaciones que no depende de los electrones, es por efectos de las interacciones magnéticas entre los espines de los protones o núcleos atómicos. Cuando esos espines están paralelos la energía de la molécula es superior a la que se presenta cuando los espines no lo están. La conversión entre esos dos estados puede tener lugar mediante la emisión o absorción de un fotón a través de la transición del dipolo magnético nuclear. Por eso las moléculas diatómicas del hidrogeno pueden constituir dos estados alotrópicos, que difieren por la relación equilibrada y establecida entre el medio y los espines de los núcleos atómicos, unos serían de la llamada forma orto y otros identificados como la forma para. La relación porcentual equilibrada entre la forma orto y para dependen de la temperatura y la presión, siendo la primera un estado de mayor energía y por eso a temperaturas muy bajas, el estado de equilibrio está compuesto casi exclusivamente por la segunda forma para. En condiciones normales de presión y temperatura el hidrogeno gaseoso contiene aproximadamente un 25% en la forma para y un 75% en la forma orto de mayor energía. La distinción entre las formas orto y para también es evidente en los grupos funcionales y moléculas que tienen hidrógenos tales como el agua o el Metileno.
Además, si se quiere se puede también aceptar como una forma alotrópica adicional que desempeña un papel importante en la química interestelar, al mencionado hidrogeno molecular protonado, quien se genera por la ionización del hidrogeno molecular provocada por los rayos cósmicos. El hidrogeno molecular protonado H3+, es un catión de trihidrogeno y es uno de los iones más abundantes del universo compuesto por tres protones con cargas positivas y un par de electrones apareados centrales de cargas negativas. El par de electrones enlazados se encuentran apareados en un orbital molecular que es central a los tres protones que mueven sus espines alrededor del par de electrones, quienes concentrados efectúan un enlace que consta de tres centros con dos electrones centrales apareados, cuestión que no igual a la situación que presentan los cuatro electrones totalmente desapareados en los cuatro centros del diborano. La situación del diborano es semejante a la que se presenta en el catión dihidrogeno H2+.
El llamado ion molecular de dihidrogeno o catión dihidrogeno H2+, que es quizás el ion molecular más sencillo y se forma a modo de un puente de electrones, sería parecido al puente que hace el protón de un hidrogeno en un enlace por puente de hidrogeno quien sería para nosotros más bien un puente de protones en contraste a nuestro puente de electrones. Este tipo de enlace covalente de un electrón en el H2+, que tiene un orden de enlace formal de un medio (1/2), encarnaría a los mismos enlaces puentes de los dos átomos de boro con los dos hidrógenos centrales en el diborano, que tiene a dos hidrógenos como puentes entre los dos átomos de boro. Cada átomo de boro utiliza su electrón libre, para hacer un ½ enlace con uno de los dos hidrógenos centrales del diborano y este a su vez, utiliza también su respectivo electrón libre, para hacer otro ½ enlace con el otro átomo de boro. El enlace covalente de un electrón o puente de electrones para nosotros, es distinto al enlace por puente de hidrogeno o puente de protones para nosotros porque para nuestro entender, el llamado puente de hidrogeno se parece más bien es a un enlace coordinado entre un átomo muy electronegativo, a quien le sobran pares libres disponibles de electrones solitarios con capacidad, de atraer a un protón que le pertenece es a un hidrogeno y quien está ya enlazado de forma iónica por el otro extremo con otro átomo que es también muy electronegativo.
Al electrón solitario que hace el puente central de electrón entre los dos protones en el catión dihidrogeno H2+, le pasa lo mismo con los dos espines de los dos protones en la precisa molécula de hidrogeno molecular, puede haber una forma orto excitada con mayor energía y otra forma para de menor energía, todo de acuerdo a las direcciones relativas que tengan los espines de los dos protones del H2+.
Por último mencionamos como otro alótropo al hidrogeno metálico, que sería un estado surgido de unas condiciones especiales de la molécula de dihidrogeno, a pesar de que sería sometida a una transición de estado en una dirección de orto hacia para a través de disminuir la temperatura, también se somete al instante a altas presiones obligándolo hacia una transición de fase contraria porque, indirectamente a través de la presión se le suministraría a los electrones la suficiente cantidad de energía que lograría desligarlos de sus núcleos con mayor facilidad, presumiendo que se comportan como electrones de conducción pertenecientes a una red cristalina de pequeños átomos de hidrogeno no degenerados pero a bajas temperaturas.
ALOTROPIA DEL OXIGENO
En condiciones normales de presión y temperatura los átomos de Oxígeno se enlazan para formar el Dióxígeno, gas diatómico tan altamente reactivo que incluso, no acepta permanecer en la atmosfera como elemento libre sin la necesidad de que sea constantemente reabastecido. Tiene el oxigeno atómico una estructura electrónica teórica basal de 1s2-2s2-2p4 pero, partiendo de que el subnivel p tiene 3 orbitales mo, m1, m2 de estructura hiperfina, con capacidad de albergar cada uno de los orbitales un número máximo de dos electrones, que aunque tengan la misma cantidad de energía y el mismo ángulo cuántico, los espines deben ser contrarios, entonces quedaría la distribución electrónica del estado fundamental basal del oxigeno atómico de la siguiente manera: 1s2-2s2-2pmo2-2pm12-2pm20. Pero resulta que por efectos de las interacciones magnéticas entre los núcleos atómicos y los electrones a presiones y temperaturas estándares, en el oxigeno molecular, el par de electrones libres del subnivel s son los de menor energía y menor ángulo cuántico, le seguirían en orden ascendente de energía los dos electrones del primer orbital 2pmo2 y finalmente los dos electrones que tendrían la mayor cantidad de energía y ángulo, que son los dos electrones del orbital 2pm12 pues ellos serían los electrones enlazantes en el oxigeno molecular. Ese par de electrones enlazantes aunque tienen espines contrarios están ubicados en el mismo orbital, tienen la misma cantidad de energía y el mismo ángulo cuántico, están a la misma altura atómica, entonces es más cómodo para ellos y con menor energía por repulsión de pares, hacer orbitales moleculares a la mayor distancia posible conformando enlaces estables entre átomos de oxigeno triplete que resultarían paramagnéticos, por eso es que en un campo magnético a altas presiones, se pueden formar largos hilos de oxigeno para las reacciones, requieren activar la ruptura inicial de esos enlaces con calor preliminar que después se continúan sin dificultad por ser rupturas fuertemente exotérmicas. En el oxigeno molecular triplete, el par de electrones en apareamiento molecular al igual que en el dihidrogeno, están ubicados en el centro del par de núcleos de los dos oxígenos y cada uno de ellos, tiene un electrón desapareado que actúa como un radical libre y tienen tanto la misma energía como el mismo ángulo cuántico de los electrones apareados, configurando tras esto una molécula que tiene un momento magnético de espín no nulo por lo que es paramagnético.
El oxigeno molecular en el llamado estado singlete, es una especie de mayor energía porque los electrones enlazantes que tiene la misma cantidad de energía y el mismo ángulo cuántico de espín, están ubicados en el mismo orbital de mayor energía, en contra de la repulsión ejercida entre pares moleculares, conforman dos pares de orbitales moleculares que unen a un par de átomos de oxigeno demasiado cercas, lo hacen acosta de la absorción de mayor energía pero con poca estabilidad, es diamagnético porque no hay radicales libres y el momento magnético de espín es nulo, una especie activada, un verdadero Dioxigeno singlete con gran accesibilidad de los cuatro pares de electrones libres.
Otro alótropo del oxigeno es el Ozono, quien es una sustancia cuya molécula está formada por tres átomos de oxigeno haciendo un ángulo central de 106,8 grados, es conocido por el importante papel que juega en la atmosfera, su principal propiedad es que es mucho más reactivo que el oxigeno molecular, es además dañino para el tejido pulmonar y es un fortísimo oxidante, desinfectante y por eso, es usado como depurador y purificador de aguas minerales.
ALOTROPIA DEL CARBONO
GRAFITO
El átomo de Carbono es sólido a temperatura ambiente y puede encontrarse natural en distintas formas alotrópicas. El Carbono tiene todas las baterías necesarias para construir tetraedros y por eso, presenta una gran afinidad para acoplarse químicamente con diferentes átomos pequeños incluyendo otros átomos de carbono, con los que puede formar largas cadenas y enlaces múltiples. Tiene un número atómico de 6 con 2 electrones en el primer nivel y 4 electrones en el segundo nivel. De los electrones del segundo nivel, dos de ellos con idéntica energía y ángulo cuántico de espín pero de espines contrarios, están apareados en el orbital s, los otros dos últimos electrones también con igual energía y ángulo cuántico pero de espines contrarios le pertenecen basalmente apareados al subnivel p: 1s2-2s2-2p2.
De los tres orbitales mo, m1, m2 de estructura hiperfina que le corresponden al subnivel p en el estado basal del átomo de carbono, consideramos que el primer orbital mo es el que podría estar lleno con los dos electrones presentes que le pertenecen basalmente a p: 1s2-2s2-2pmo2-2pm10-2pm20.
Estudiando a los dos electrones que ocupan al subnivel s del segundo nivel vemos que como son electrones s y están apareados, construyen bandas prohibidas muy fuerte que hay que romper, entonces por adquirir mayor energía salta solo uno de ellos a acompañar a los dos electrones basales del subnivel p del átomo de carbono, incremento originado por la ampliación de los números cuánticos y el ángulo del momento angular debido a los efectos de las interacciones magnéticas entre los espines de los núcleos atómicos con los espines de los electrones y las precisas condiciones ambientales de presión y temperatura, si ese electrón s salta igualando a la cantidad energética que tienen los dos electrones que ocupan al primer orbital vecino mo del subnivel p, que por principio adquiriría distintos números cuánticos y mayor ángulo y cantidad de energía, esto hace que quede en el átomo de carbono la siguiente distribución electrónica hibrida sp2 de la siguiente manera: 1s2-2s1-2pmo1-2pmo1-2pm01-2pm10.2pm20. Los 3 electrones enlazantes del segundo nivel del átomo de carbono, quedan como electrones p ubicados esta vez con la misma energía en el primer orbital mo del subnivel p. Ese estado de hibridación excitada del átomo de carbono, no surge para seguir permaneciendo basalmente en ella sin formar orbitales moleculares, por lo contrario es suscitada para formar tres orbitales localizados moleculares enlazados entre carbono y carbono en un mismo plano. Quedaría ubicado solitario en el subnivel s un solo electrón deslocalizado. Parece con esto que los 3 electrones del subnivel p estuvieran violando al principio de exclusión de Pauli por el espín pero no es así porque a pesar de que son 3 electrones que tienen igual ángulo cuántico de espín y la misma cantidad de energía, tienen distinta dirección espacial. Estarían inhabitados los dos orbitales m1 y m2 del subnivel p. Es decir que en vista de esto se debe es incorporar como observable cuántico adicional a la dirección y el sentido espacial en que se mueve un par de electrones al Principio de Exclusión de Pauli, constituyendo así al átomo de Carbono que siempre configura un tetraedro que es la estructura del Grafito como alótropo de ese elemento. Debido a que la base del grafito consta de tetraedros, hace que los planos del grafito forzosamente se curven con la aparición de estructuras de formas esféricas, elipsoidales o cilíndricas. Los nanotubos son un ejemplo y los fullerenos que tienen una organización similar al grafito con una estructura tridimensional geométrica que es similar a un especialmente estable balón de futbol.
Entonces, de los 3 electrones ubicados con la misma energía y ángulo cuántico en el primero de los tres orbitales del subnivel p, establecen enlaces covalentes formando orbitales moleculares localizados de carbono a carbono adyacentes. En el subnivel 2s de cada carbono sobra un electrón desapareado que conforma con el átomo de carbono vecino, un par de Cooper de electrones deslocalizados, quienes conservan la cualidad de construir suficientes bandgap, quienes establecen en la misma lámina de grafito un fenómeno parecido a la mesomería o resonancia del benceno. Este par deslocalizado de Cooper que se puede mover en toda la lámina de grafito, además de conferirle las características eléctricas a ese alótropo del carbono, es otra razón adicional que tiene al grafito para curvarse y conservar la resonancia. Si conectáramos el Benceno a un campo eléctrico, quizás le pasaría de manera lineal lo mismo que le sucede eléctricamente en un plano al grafito.
Los tres orbitales moleculares enlazantes y localizados que construye con su vecino cada átomo de carbono en el grafito, no instituyen ningunas rutas para que transiten los electrones que significan la conducción eléctrica, no señor ellos no representan ninguna vía eléctrica. Si los orbitales moleculares sirvieran de caminos eléctricos el diamante fuera un gran conductor de la electricidad. El par de Cooper en el grafito permanece alojado intraatómicamente en el subnivel s del núcleo de los carbonos, sitio donde podría persistir indefinidamente orbitando. Sin embargo los pares de Cooper en el grafito, deslocalizados se desplazan ruidosamente saltando de núcleo en núcleo de los átomos de carbonos vecinos. Se deslocalizan por razones eléctricas pues, cuando el par está ubicado orbitando en uno cualquiera de los átomos de carbonos, se convierte en un anión y el carbono vecino tendría carga contraria.
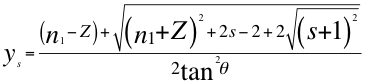 (3)
(3)
Donde ys es la relación entre n y el ángulo θ descrito por la cantidad de movimiento y el radio de la órbita del electrón siendo n un número no entero, n1 es el número cuántico principal y s es el segundo número cuántico.
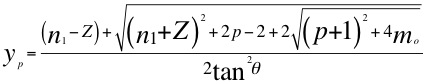 (4)
(4)
Donde yp es la relación entre n y el ángulo θ descrito por la cantidad de movimiento y el radio de la órbita del electrón siendo n un número no entero, n1 es el número cuántico principal, p es el segundo número cuántico y mo es el tercer número cuántico o número cuántico magnético.
![]() (5)
(5)
En el Grafito entonces, tres electrones ubicados en tres vértices distintos del respectivo primer orbital del subnivel p de la estructura anterior, efectúan los 3 enlaces carbono a carbono del alótropo, quedando aparentemente un electrón desapareado, deslocalizado, inquieto y solitario en el respectivo subnivel s, quien apareado sería el par de Cooper responsable de las propiedades eléctricas que tiene el grafito en dirección carbono a carbono. Los 3 electrones híbridos sp2 del grafito podrían situarse en el primer orbital mo del subnivel p, sin embargo de acuerdo a las condiciones ambientales de presión y temperaturas también podrían instalarse con mayor energía en el segundo orbital m1 o finalmente, podrían hacerlo en el orbital m2 que es el ultimo orbital de los 3 que le corresponden al subnivel p. Esta posibilidad de ocupar los distintos orbitales explica las 3 formas conocidas del grafito que son: la forma amorfa que no llega a adoptar una estructura cristalina macroscópica pero que es esencialmente grafito, la forma beta romboédrica y finalmente la forma alfa hexagonal de posible mayor cantidad de energía.
El DIAMANTE
Si al alótropo del grafito, lo sometemos a altas temperaturas y presiones, todos los 4 electrones, tanto los dos procedentes del subnivel s como los dos procedentes del subnivel p, ocuparían ya sea al orbital mo, m1 o m2 del subnivel p con mayor cantidad de energía, harían enlaces en direcciones distintas tetraédricas. Quedando el átomo de Carbono preparado ahora con 4 electrones enlazantes, que a pesar de que poseen igual cantidad de energía ya que tienen los mismos números cuánticos y describen el mismo ángulo cuántico, porque se hallan ubicados en el mismo orbital de similar subnivel, a pesar de eso poseen distintas direcciones espacio temporales, con ellos hacen los 4 enlaces moleculares localizados, híbridos, tetraédricos, propios del diamante y podrían existir varios tipos de diamantes por ejemplo, el que tenga los 4 electrones desapareados ubicados todos ellos en el primer orbital mo del subnivel p del segundo nivel como el caso siguiente: 1s2-2s0-2pmo1-2pmo1-2pmo1-2pmo1. Un segundo tipo de diamante sería el que tendría los 4 electrones ubicados todos ellos en el segundo orbital m1 quedando así: 1s2-2s0-2pm11-2pm11-2pm11-2pm11. Un tercer tipo de diamante sería en el que los electrones desapareados estarían todos en el orbital m2 de mayor energía quedando así: 1s2-2s0-2pm21-2pm21-2pm21-2pm21. Todos estos 3 diamantes dependen de la cantidad de presión y temperatura en el tiempo.
CONDUCTIVIDAD ELECTRICA
Recordemos que el ángulo cuántico de espín en los átomos de la tabla periódica incrementa su valor de arriba hacia abajo y de izquierda a derecha, lo que nos dice que en un no metal como es el carbono, es mayor que en el metaloides boro. A pesar de que en un metal del bloque p como el aluminio, es mayor el ángulo que en el carbono. Pero en un metal de transición como el cobre es de mayor ángulo que en el aluminio, sin embargo en la plata es mayor que el cobre pero es menor que en el oro.
Si solamente el valor del ángulo cuántico de espín definiera a la conductividad, el oro debiera ser mejor conductor eléctrico que la plata y que el mismo cobre. Pero la desventaja es que además de tener en su último nivel de energía a los subniveles s nativos y d del respectivo nivel anterior como los tienen el cobre y la plata, además de ellos el oro tiene también al subnivel f del nivel anterior pero está presente en su último nivel de energía, cuestión que le incrementa la carga nuclear efectiva relativa y entonces hace igual con la electronegatividad, que hacen todos los metales de transición situados desde el sexto período de la tabla periódica a partir del sexto grupo.
Se puede notar en la tabla periódica que si bien es cierto que la electronegatividad y la carga nuclear efectiva de forma general se incrementan, de abajo hacia arriba y de izquierda a derecha, sin embargo tenemos que resaltar en los elementos de transición a partir del cromo, un elemento que está ubicado en el 6º período y 6º grupo de la tabla periódica, desde allí ese orden que trae hacia arriba el crecimiento de la electronegatividad y la carga nuclear efectiva se rompe porque a pesar de que sí continúa el compás incrementándose de izquierda a derecha con esa misma disposición, el ritmo vertical de crecimiento se invierte y cambia, pues su incremento desde ese punto es de arriba hacia abajo hasta llegar al mercurio y lo rompen los subniveles d y f que se llenan de fuera hacia adentro.
La conductividad eléctrica en este artículo parte de la base de que siempre el transporte de la carga eléctrica en materiales no superconductores, no ocurriría jamás a través de electrones libres, sino para todo siempre sería portada por pares de electrones, además serían electrones de tipo s es decir, tendrían simetría esférica y el espín total sería nulo. Parece que los metales de transición esperaran a la conducción eléctrica con el subnivel s, siempre ubicada en su último orbital incluso, el orden de llenado electrónico del subnivel d en los elementos de transición, es de adelante hacia atrás, de la periferia hacia el centro.
Para aplicar los principios de conductividad eléctrica esbozados en el grafito, nos vamos a referir a la descripción de los átomos de bromo, aluminio, plata, cobre y oro que son elementos que quedan con un solo electrón desapareado y deslocalizado en el subnivel s de sus formas alotrópicas.
El aluminio de número atómico 13, lo que quiere decir que tiene el mismo número de electrones, con 2 de ellos en el primer nivel, 8 electrones en el segundo nivel y finalmente 3 de ellos en el último tercer nivel de energía. Los tres electrones de valencia en el tercer nivel de energía basalmente en un átomo neutro estarían ubicados de la siguiente manera: 3s2-3pm01-3pm10-3pm20. Dos de esos electrones están apareados con espines contrarios e igual energía en el subnivel s. El último de los 3 electrones de valencia estaría desapareado en el primer orbital m0 de los tres que le corresponden al subnivel p. Uno de los dos electrones ubicados en el subnivel s incrementaría su energía e igualaría a la energía del electrón ubicado originalmente en el subnivel p, entonces los 2 electrones se ubican al mismo nivel como 2 electrones enlazantes, cada uno de ellos se enlazan lateralmente con otro átomo de aluminio, quedando cada átomo de aluminio con un electrón desapareado en el subnivel s, que al aparearse con el electrón del aluminio vecino igual que en el grafito, son los pares de electrones que completan la resonancia como sucede en el grafito y el benceno.
Podemos darnos cuenta que el benceno, el grafito, el bromo puro, el aluminio, el cobre, la plata y el oro, todos lo hacen a través de los electrones apareados y deslocalizados de los subniveles s.
SUPERCONDUCTIVIDAD
Las órbitas electrónicas por pares alrededor del núcleo atómico crean un campo magnético suficiente para sustentar el efecto Meissner y por esto, los electrones pueden permanecer indefinidamente orbitando en el respectivo orbital de un subnivel y esta es la razón de que la cantidad de electrones superconductores es finita pues la cantidad de corriente que puede soportar el material es limitada por tanto, también existe una corriente crítica a partir de la cual el material deja de ser superconductor y comienza a disipar energía. Debido a que la interacción de los pares de electrones no es la misma en cualquier dirección, la simetría espacial esférica tipo s es la que sustenta al efecto Meissner.
Un par de Cooper que se encuentre debidamente apareado orbitando el subnivel s en un átomo de un conductor, inmediatamente lo convierte en anión, que obliga al par a través del efecto túnel, a tener que saltar con ruido y vibración al átomo vecino que incluso ya viene con carga contraria, este salto produce menos ruido o vibración si el átomo está más cerca y vibra menos, esta distancia y vibración depende de la temperatura, a la vez la misma temperatura incrementa la misma separación y vibración de los átomos. Desde la temperatura crítica hacia abajo, los iones atómicos serán adyacentes por la atracción sentida debido a la carga contraria y el par de Cooper fluirá a través de ellos por el efecto túnel. Pero si se modificara la masa del ion en el efecto isotópico, como la carga sigue constante, la densidad de carga por ión también se altera, varia la fuerza de atracción por carga contraria entre iones, se altera la temperatura crítica. Por eso vemos que si isotópicamente se incrementa la masa del superconductor la temperatura crítica disminuye.
El punto de la corriente crítica es algo que queremos abordar de la siguiente manera diciendo: Que los elementos puros o aleaciones que no presentan estado superconductor, es porque quizás tengan una corriente crítica demasiado minúscula y podría ser el caso del grafito. Sostenemos esta premisa viendo el hecho de que el grafito laminar no es superconductor porque quizás el valor de la corriente crítica forzada linealmente en una misma dirección, es demásado minúscula, pero si esta misma lamina se enrolla conformando un nanotubo, se vuelve un material que potencialmente incrementa de manera general el valor soportable de la corriente crítica pudiendo ser un superconductor.
3- Conclusiones:
1- LA PRIMERA GRAN CONCLUSIÓN de este trabajo es el planteo en la posibilidad de poder construir nanotubos multicapas aislados multiplicador de la corriente crítica de un nanotubo monocapa. Conseguirían ser nanotubos multicapas aislados con nitrógeno líquido capaz de traer desde las alturas suficiente cantidad de energía solar captada por células solares pertenecientes a un panel flotante.
1- LA SEGUNDA GRAN CONCLUSIÓN de este trabajo es la gran relación de los cuatro números cuánticos con el ángulo cuántico de espín: El primer número cuántico o principal n1, el segundo número cuántico o azimutal l, el tercer número cuántico o magnético m, el cuarto número cuántico del espín s, cada número cuántico tiene un ángulo cuántico distinto y la dirección del orbital:
![[1] Alotropía. [2] Alotropía del Carbono.](/imagenes/fisica/superconductividad-acoplamiento-6.png) (20)
(20)
Donde n es un número no entero, n1 es el primer número cuántico o principal, Z es el número atómico, l es el segundo número cuántico o acimutal y m es el tercer número cuántico o número cuántico magnético.
2- LA TERCERA GRAN CONCLUSIÓN de este artículo es la relación de la energía cinética del electrón, donde se encuentran involucrados los tres números cuánticos y el ángulo cuántico del momento angular del electrón:
![[1] Alotropía. [2] Alotropía del Carbono.](/imagenes/fisica/superconductividad-acoplamiento-7.png) (59)
(59)
Donde p es la cantidad de movimiento del electrón, Ec es la energía cinética del electrón, me es la masa del electrón, Z es el número atómico, α es la constante de estructura fina, yn es la relación entre n y el ángulo θ descrito por la cantidad de movimiento y el radio de la órbita del electrón.
![[1] Alotropía. [2] Alotropía del Carbono.](/imagenes/fisica/superconductividad-acoplamiento-8.png) (40)
(40)
Donde Et es la energía total del electrón, me es la masa en reposo del electrón, Z es el número atómico, α es la constante de estructura fina, yn es la relación entre n y el ángulo θ descrito por la cantidad de movimiento y el radio de la órbita del electrón.
Este trabajo demuestra que el ángulo cuántico del momento angular total de la órbita del electrón, es una propiedad intrínseca que además de establecer el grado de acoplamiento creado entre el espín de la partícula y la órbita del electrón, es aquella cantidad atómica de variación periódica que contribuye tanto al valor de la energía como a la calidad del apareamiento que tendrían un par de electrones en un orbital basal o molecular y que en base a eso, establece las distintas propiedades eléctricas quien además de influir en la electronegatividad, la afinidadelectrónica y la energía de ionización, revela mecanismos precisos que explican a las respectivas alotropías, a los orbitales moleculares y a las distintas anomalías presentes en la secuencia atómica de la carta periódica por ejemplo, el apareamiento electrónico basal no alotrópico explica el intenso valor relativo que pretende la primera energía de ionización en los grupos 2, 12, 14, 16, 18 y por apareamiento alotrópico solo la gran primera energía de ionización del grupo 15, a la vez es la misma fuente que origina a los regios decaimientos inesperados en sus respectivas afinidades electrónicas. Lo contrario ahora, el desapareamiento electrónico basal no alotrópico es la causa del gran decaimiento relativo que tiene la primera energía de ionización en los grupos 1, 6, 11, 13, 15 y 17 y a la vez es la misma razón, que origina el incremento aparentemente inesperado en la afinidad electrónica de esos mismos grupos. El efecto predominante de un ángulo cuántico de espín, explica la mayor a afinidad electrónica del cloro frente al flúor. Explica el porqué el paladio pertenece al quinto período de la tabla periódica. Explica el porqué el grafito tiende a configurar estructuras alotrópicas cilíndricas y esféricas. Estos artículos manifiestan que no basta con solamente decir que un par de electrones están apareados, se hace necesario establecer el grado relativo del respectivo apareamiento que se crea entre ellos y definir la medida y decir si es un apareamiento basal o es un apareamiento alotrópico para poder entenderlo.
4- Referencias
REFERENCIAS DEL ARTÍCULO.
[1] Alotropía.
[2] Alotropía del Carbono.
[3] Alotropía del Oxigeno.
[4] Ozono.
[5] Diborano
REFERENCIAS DE LA TEORÍA
[1] Número cuántico magnético.
[2] Ángulo cuántico
[3] Paul Dirac y Nosotros
[4] Numero cuántico Azimutal monografias
[5] Numero cuántico Azimutal textoscientificos
[6] Inflación Cuántica textos científicos.
[7] Números cuánticos textoscientíficos.com.
[8] Inflación Cuántica Monografías
[9] Orbital Atómico
[10] Números Cuánticos.
[11] Átomo de Bohr.
[12] Líneas de Balmer.
[13] Constante Rydberg.
[14] Dilatación gravitacional del tiempo.
[15] Número Cuántico magnético.
[16] Numero Cuántico Azimutal.
Copyright © Derechos Reservados.
Heber Gabriel Pico Jiménez MD. Médico Cirujano 1985 de la Universidad de Cartagena Colombia. Investigador independiente de problemas biofísicos médicos propios de la memoria, el aprendizaje y otros entre ellos la enfermedad de Alzheimer.
Estos trabajos, que lo más probable es que estén desfasados por la poderosa magia secreta que tiene la ignorancia y la ingenuidad, sin embargo, como cualquier representante de la comunidad académica que soy, también han sido debidamente presentados en la “Academia Colombiana de Ciencias Exactas, Físicas y naturales” ACCEFYN.