Cuando el sistema que evoluciona es abierto, su masa varía durante el proceso, por consiguiente interesa el trabajo realizado por la unidad de masa que se “mueve” o “circula” durante el proceso.
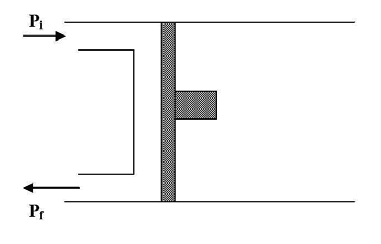
Este trabajo se denomina trabajo de circulación WC.
Supongamos un gas que puede evolucionar en un cilindro moviendo un pistón.
El gas inicia el proceso entrando al cilindro a presión Pi dentro del mismo se expande hasta presión P y sale al exterior a presión Pf. El trabajo de circulación será la suma del trabajo realizado para la entrada de gas (Wi), en la expansión (We) y para la salida del gas (Wf) es decir:
WC =Wi +We +Wf (14)
Como a la entrada el volumen (específico) toma el valor vi y la presión Pi es constante:
![]()
En la expansión, como P varía entre Pi y Pf :
![]()
Y a la salida Pf es constante y el gas escapa a vf:
![]()
Reemplazando en la ecuación (14)
![]()
Si representamos gráficamente en un diagrama P-V todo el proceso, observamos que el trabajo de circulación resulta el área limitada por la transformación, las abscisas extremas y el eje de las ordenadas.
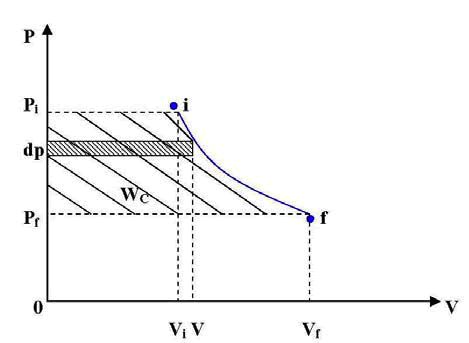
Tomando el diferencial de presión dp, el
área elemental será el producto v.dp, en
consecuencia el área total que representa
el trabajo de circulación valdrá:
![]() (15)
(15)
Para un proceso elemental, el trabajo de circulación será:
δWC = −v.dp (16)
En la expresión (15) el segundo miembro lleva el signo negativo para que WC sea positivo, ya que en la expresión como Pi>Pf el valor de:
![]() es negativo.
es negativo.
Según la definición de entalpía: H = U + PV
Diferenciando: dH = dU + Pdv +Vdp
Por la ecuación (8) : dH = δQ +Vdp y despejando δQ = dH −Vdp (17)
Reemplazando (16) en (17):
δQ = dH +δWC (18)
Esta es otra expresión del primer principio de la termodinámica que para un proceso entre un estado inicial y final se puede escribir:
Q = ΔH +WC (19)