Origin of the rotational barrier of ethane
Por Heber Gabriel Pico Jiménez MD
Resumen
La Nueva Regla del Octeto alcanza descubrir que los seis hidrógenos de la molécula de Etano, además de que no tienen la misma carga eléctrica tampoco tienen configuraciones de valencias iguales. Aquí se descubre que siempre que surja la presencia de un carbocatión, es porque han existido enlaces coordinados previos que han aprovechado la presencia estratégica de unos pares de electrones y huecos libres de valencia. Los enlaces coordinados no encuentran cabida en la Teoría de los Orbitales Moleculares o en la Teoría del Campo de Ligandos, entonces el problema del origen en la barrera rotacional del enlace del Etano, debe resolverlo una Teoría del Enlace de Valencia, que esté adecuadamente oxigenada por nuevos conceptos teóricos como la Nueva Regla del Octeto.
Palabras claves: Enlace Coordinado, Carbocationes.
Abstract
The New Rule of Byte reaches discover the six hydrogens of the ethane molecule, in addition to not having the same electric charge nor have equal value settings. Here is discovered that whenever arising out the presence of a carbocation, it is because there have been previous coordinated links that have seized the strategic a few pairs of electrons and holes free of Valencia presence. Coordinated links do not find place in the Ligand Field Theory or Molecular Orbital Theory, then the problem of the origin in the rotational barrier of ethane link, should resolve it a Bond Theory of Valencia that is properly oxygenated by new theoretical concepts as the New Rule of the Byte.
Keywords: Coordinated links, Carbocations.
1. Introducción
Precisamos que todo el desarrollo de este artículo, estará siempre sostenido en el principio de que químicamente los electrones por lo general, estarán casi siempre apareados. Bajo este principio se desarrollan los anteriores trabajos de energía atómica Número cuántico magnético del electrón, el trabajo de la superconductividad, el artículo del acoplamiento espín-órbita del electrón, además el anterior trabajo de Semiconductores y el de Células fotoeléctricas publicado en textoscientificos y Monografías. También este artículo se basa en la nueva regla del octeto.
En la molécula de monóxido de carbono el átomo de carbono se comporta como un nucleófilo rico en electrones es decir como un carbanión.
2. Desarrollo del Tema.
En la química hay unos problemas no resueltos los cuales son preguntas o cuestiones persistentes que tienen implicaciones actuales y profundas. Hay fenómenos como la racionalización de la solvolisis del catión norvornilo, además otra cuestión de la química es la identificación del origen de la barrera de rotación del enlace del etano que nosotros atribuimos al mismo origen de un carbocatión en un sistema químico.
La sustitución nucleófila es un tipo de reacción de sustitución en la que un nucleófilo “rico en electrones”, reemplaza a un átomo o grupo en una posición electrófila “pobre en electrones” de una molécula. En química orgánica la reacción se produce sobre un carbono electrófilo.
La salvolisis es un tipo especial de sustitución nucleófila donde el nucleófilo es una molécula disolvente.
Sabemos que por la nueva regla del Octeto el átomo de carbono, puede tener las dos siguientes configuraciones estructurales de valencia:
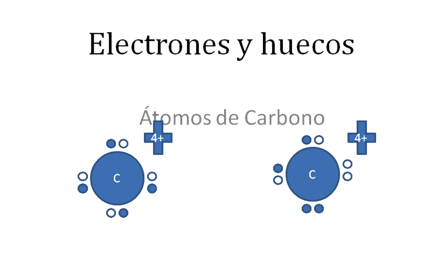
Cada átomo de carbono tiene a 4 electrones de valencia identificados por círculos pequeños rellenos y los 4 huecos representados por círculos pequeños vacíos.
Figura No.1
De las dos distribuciones de valencias descritas en la figura anterior, nos quedamos con la distribución de valencia de la siguiente figura del átomo de carbono, encontramos en ella a un par de huecos libres y a un par de electrones libres en la valencia del mismo átomo de carbono:
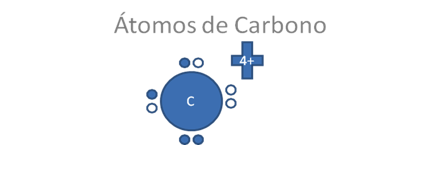
El átomo de carbono tiene a 4 electrones de valencia y dos de ellos están apareados con dos huecos, los pequeños círculos rellenos corresponden a los electrones y los pequeños círculos vacíos corresponden a los huecos.
Figura No.2
Este átomo de carbono de la anterior figura puede construir a dos enlaces covalentes coordinados con dos átomos de elementos distintos.
También puede construir a dos enlaces covalentes ordinarios tipo I o tipo mixto-mixto con dos átomos de hidrógeno tal como lo describe la siguiente figura:
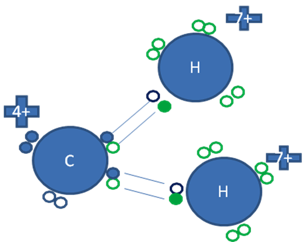
Los pequeños círculos rellenos de azul son los electrones del átomo de carbono, los pequeños círculos rellenos de verdes son los electrones de los átomos de hidrógeno y los círculos pequeños y vacíos son los huecos.
Figura No.3.
Este átomo de carbono de la figura anterior que ha efectuado a dos enlaces covalentes tipo I o tipo mixtos-mixtos distintos y con dos átomos de hidrógenos distintos, a ese carbono le quedan una par de electrones libres y un par de huecos libres, es decir él puede adicionalmente hacer dos enlaces covalentes coordinados, en uno como dador de electrones y en otro un enlace coordinado donde el participa como aceptor de electrones.
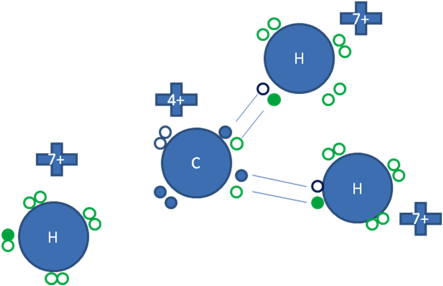
Los pequeños círculos rellenos de azul son los electrones del átomo de carbono, los pequeños círculos rellenos de verdes son los electrones de los átomos de hidrógeno y los círculos pequeños y vacíos son los huecos.
Figura No.4.
Si le ponemos al frente a otro átomo de hidrogeno sin todavía hacer enlace entre ellos, el carbono cede un electrón al hidrógeno y recibe un hueco, esto hace que la presencia de un carbocatión primario sea muy inestable.
CARBOCATIÓN PRIMARIO TIPO CERO
El carbocatión primario tipo cero tiene 3 hidrógenos unidos al átomo de carbono ionizado, pero el enlace covalente con uno de esos tres hidrógenos es un enlace covalente coordinado distinto, porque es un enlace utilizando al par de electrones libres y por ello es altamente inestable.
En el carbocatión primario tipo cero el átomo de carbono queda con un par de huecos lo que lo señala como un objetivo nucleófilo.
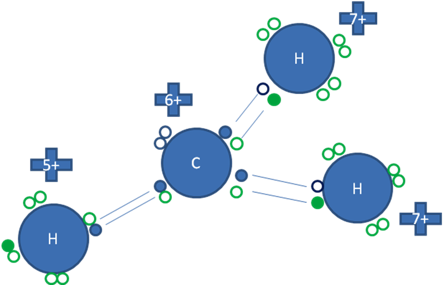
Los pequeños círculos rellenos de azul son los electrones del átomo de carbono ionizado, los pequeños círculos rellenos de verdes son los electrones de los átomos de hidrógeno y los círculos pequeños y vacíos son los huecos.
Figura No.5.
CARBOCATIÓN PRIMARIO TIPO UNO e INESTABLE
Un carbocatión primario tipo uno es aquel que tiene solo a un átomo de carbono unido al carbón ionizado, pero ese carbono no está unido por el enlace coordinado y como la estabilidad de los carbocationes se incrementa con el número de grupos alquilo unidos al átomo de carbono que lleva la carga eléctrica, a pesar de eso no es la misma estabilidad con el tipo de enlace.
El carbocatión primario tipo uno e inestable, es aquel en el que el átomo de carbono ionizado está enlazado por un enlace covalente ordinario con el grupo alquilo primario mientras aun le queda unido de forma coordinada todavía uno de los dos hidrógenos.
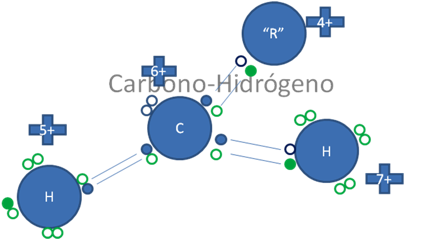
Los pequeños círculos rellenos de azul son los electrones del átomo de carbono ionizado, los pequeños círculos rellenos de verdes son los electrones de los átomos de hidrógenos y los círculos pequeños y vacíos son los huecos, R es el radical alquilo.
Figura No.6
CARBOCATIÓN PRIMARIO TIPO UNO y más ESTABLE
Cuando un carbocatión primario está unido por el enlace coordinado al primer carbón del único radical alquilo de la molécula, entonces este para no convertirse en un carbanión, establece reordenamiento con dobles enlaces con el carbono siguiente, esto ocurre en el catión Alilo y el catión Bencilo.
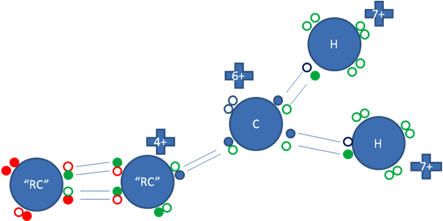
Los pequeños círculos rellenos de azul son los electrones del átomo de carbono ionizado, los pequeños círculos rellenos de verdes son los electrones del carbono “alfa” del radical alquilo y de los hidrógenos, los círculos rellenos de rojo son los electrones del carbono “beta” del radical alquilo y los círculos pequeños y vacíos son los huecos, “RC” es el radical alquilo.
Figura No.7.
CARBOCATIÓN SECUNDARIO
Los carbocationes secundarios tienen a dos átomos de carbono unidos al carbón ionizado. Son más estables que los carbocationes primarios pero menos que el terciario.
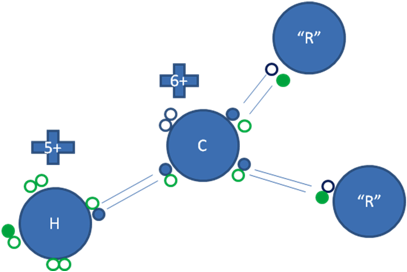
Los pequeños círculos rellenos de azul son los electrones del átomo de carbono ionizado, los pequeños círculos rellenos de verdes son los electrones de los átomos de hidrógenos y los radicales, los círculos pequeños y vacíos son los huecos, “R” son los dos radicales alquilos.
Figura No.8.
CARBOCATIÓN TERCIARIO
Un carbocatión terciario tiene a tres átomos de carbono unidos al carbono ionizado, son más estables que los carbocationes secundarios.
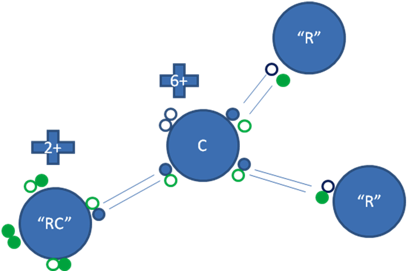
Los pequeños círculos rellenos de azul son los electrones del átomo de carbono ionizado, los pequeños círculos rellenos de verdes son los electrones de los radicales alquilos, los círculos pequeños y vacíos son los huecos, “R” es el radical alquilo y “RC” es el primer carbono del radical alquilo unido por enlace coordinado al carbocatión.
Figura No.9.
HIPERCONJUGACIÓN
La hiperconjugación es una interacción estratégica que estabiliza a un carbocatión, es decir darle estabilidad a un par de huecos libres.
Solo el carbono beta con respecto a un carbocatión, puede estabilizarlo por hiperconjugación.
Veamos la anterior figura No. 7 donde el carbono beta es un carbanión que tiene un par de electrones libres.
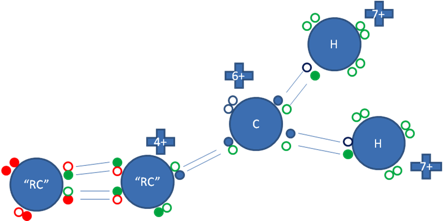
Los pequeños círculos rellenos de azul son los electrones del átomo de carbono ionizado, los pequeños círculos rellenos de verdes son los electrones del carbono “alfa” del radical alquilo y de los hidrógenos, los círculos rellenos de rojo son los electrones del carbono “beta” del radical alquilo y los círculos pequeños y vacíos son los huecos, “RC” es el radical alquilo.
Figura No.7.
En la siguiente figura el carbono “alfa” del radical alquilo, se estabiliza gracias a un enlace coordinado con un hidrogeno.
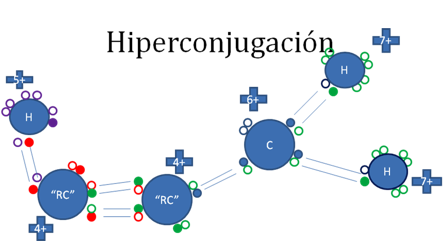
Los pequeños círculos rellenos de azul son los electrones del átomo de carbono ionizado, los pequeños círculos rellenos de verdes son los electrones del carbono “alfa” del radical alquilo y de los hidrógenos unidos al carbocatión, los círculos rellenos de rojo son los electrones del carbono “beta” del radical alquilo, los pequeños círculos rellenos de purpura son los electrones del hidrógeno enlazado al carbono “beta” y los círculos pequeños y vacíos son los huecos, “RC” es el radical alquilo.
Figura No.10.
El carbono “alfa” del radical alquilo de la figura anterior, ya estabilizado, efectúa con el carbocatión, un enlace estabilizador del carbocatión con tres centros y dos electrones.
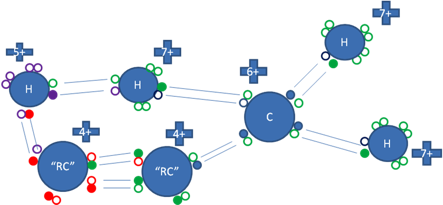
Los pequeños círculos rellenos de azul son los electrones del átomo de carbono ionizado, los pequeños círculos rellenos de verdes son los electrones del carbono “alfa” del radical alquilo y de los hidrógenos enlazados al carbocatión, los círculos rellenos de rojo son los electrones del carbono “beta” del radical alquilo, los círculos pequeños rellenos de purpura son los electrones del hidrógeno enlazado al carbono “beta” y los círculos pequeños y vacíos son los huecos, “RC” es el radical alquilo.
Figura No.11.

Los pequeños círculos rellenos de azul son los electrones del átomo de carbono ionizado, los pequeños círculos rellenos de verdes son los electrones del carbono “alfa” del radical alquilo y de los hidrógenos enlazados al carbocatión, los círculos rellenos de rojo son los electrones del carbono “beta” del radical alquilo, los círculos pequeños rellenos de purpura son los electrones del hidrógeno enlazado al carbono “beta” y los círculos pequeños y vacíos son los huecos, “RC” es el radical alquilo.
Figura No.11.
ORIGEN de la BARRERA de ROTACIÓN del ENLACE en el ETANO
Iniciamos por pasos la descripción del origen en la barrera de rotación del enlace del Etano, partiendo de dos átomos de carbono:
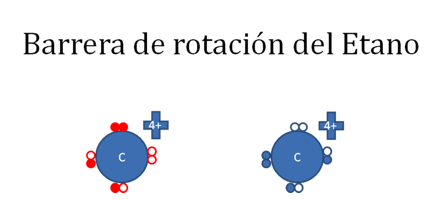
Los círculos rellenos de rojo representan a los electrones del carbono de la izquierda, los círculos rellenos de azul representan a los electrones del carbono de la derecha, los círculos vacíos representan a los huecos.
Figura No.12.
Los dos átomos de carbono de la figura anterior establecen un enlace covalente coordinado entre ellos donde el carbono de la derecha es el átomo dador. Tras esto el carbono de la derecha se convierte en un carbocatión mientras el carbono de la izquierda es un carbanión.
Los círculos rellenos de rojo representan a los electrones del carbono de la izquierda, los círculos rellenos de azul representan a los electrones del carbono de la derecha, los círculos vacíos representan a los huecos.
Figura No.13.
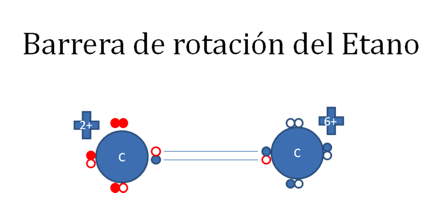
Los dos carbonos lateralmente cada uno de ellos establecen dos enlaces covalentes ordinarios tipo I o los mismos enlaces covalentes tipo mixto-mixto con dos hidrógenos distintos, son enlaces que no alteran la carga eléctrica de los carbonos.
Los círculos pequeños rellenos de rojo representan a los electrones del carbono de la izquierda, los círculos pequeños rellenos de azul representan a los electrones del carbono de la derecha, los círculos pequeños rellenos de verde representan a los electrones de los hidrógenos y los círculos vacíos representan a los huecos.
Figura No.14.
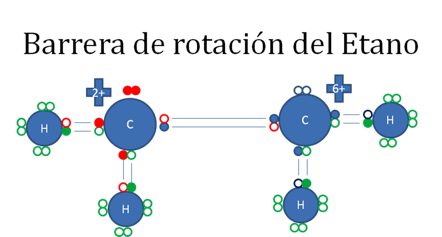
El carbanión de la izquierda buscando estabilidad efectúa un enlace covalente coordinado con un tercer hidrógeno. Este enlace del carbanión altera la carga eléctrica y características estereoquímicas de ese tercer hidrógeno en el etano.
Los círculos pequeños rellenos de rojo representan a los electrones de carbono de la izquierda, los círculos pequeños rellenos de azul representan a los electrones del carbocatión de la derecha, los círculos pequeños rellenos de verde representan a los electrones de los hidrógenos y los círculos vacíos representan a los huecos.
Figura No.15.
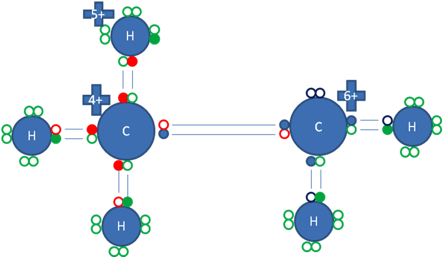
Ese tercer hidrógeno del carbono de la izquierda buscando estabilidad, establece hiperconjugación con el otro hidrógeno que ha alcanzado estabilizar al carbocatión del extremo derecho del Etano.
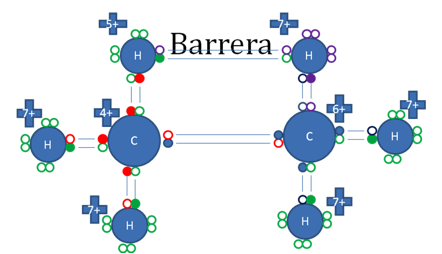
Los círculos pequeños rellenos de rojo representan a los electrones del carbono de la izquierda, los pequeños círculos rellenos de azul representan a los electrones del carbocatión de la derecha, los círculos pequeños rellenos de verde representan a los electrones de 5 hidrógenos, los círculos pequeños rellenos de purpura representan al sexto hidrógeno que estabiliza al carbocatión, los círculos vacíos representan a los huecos.
Figura No.16.
ENLACE COORDINADO
El enlace coordinado es un enlace configurado por una base de Lewis y un ácido de Lewis.
La base de Lewis tiene disponibles a un par de partículas apareadas con cargas eléctricas negativas como un par electrones libres.
Pues respectivamente el ácido de Lewis también tiene disponibles a un par de partículas apareadas con cargas eléctricas contrarias como un par de huecos libres apareados.
Los pares de electrones y huecos hacen un intercambio de partículas, constituyendo pares mixtos que después se aparean con mayor fuerza en un enlace covalente tipo I o enlace covalente tipo mixto-mixto.
SIMILITUD entre la VALENCIA de un CARBOCATIÓN y la VALENCIA del átomo de BORO
La valencia de un átomo de boro es idéntica a la valencia de un carbocatión.
El boro tiene apareados a un par de huecos libres, igual que el carbocatión.
El boro tiene a tres electrones apareados de forma mixta con tres electrones distintos, igual los tiene el carbocatión.
La diferencia es que el átomo de boro tiene un número de protones distintos a los que tiene el carbono.
Otra gran diferencia es que el carbocatión tiene una carga eléctrica de +6 mientras que el boro tiene una carga eléctrica de +5.
3- Conclusiones:
1- LA PRIMERA Y ÚNICA GRAN CONCLUSIÓN de este artículo es que en realidad, los huecos revolucionan a la fisicoquímica, por las grandes repercusiones que tiene en la carga eléctrica de los átomos en las moléculas. Si bien es cierto que este artículo es solo teoría y que hace falta sobretodo probar en unos semiconductores propuesto en el trabajo de células fotoeléctricas. Además hay fenómenos indiscutibles, como son la identificación de dos tipos de enlaces covalentes en las moléculas hipervalentes, la descripción de los iones divalentes de plomo, etc, etc. Es probable también que el hueco como partícula, explique las anomalías en la configuración electrónica que tienen los elementos de transición.
4- Referencias
REFERENCIAS DEL ARTÍCULO.
[2] Nueva regla fisicoquímica del octeto
[3] Células fotoeléctricas Monografías.
[4] Células Fotoeléctricas textoscientificos.
[5] Semiconductores Monografías.
[6] Semiconductores textoscientificos.
[7] Superconductividad.
[8] Superconductividad.
[9] Alotropía.
[10]Alotropía del Carbono.
[11]Alotropía del Oxigeno.
[12]Ozono.
[13]Diborano
[14]Semiconductores y temperatura.
REFERENCIAS DE LA TEORÍA
[1] Número cuántico magnético.
[2] Ángulo cuántico
[3] Paul Dirac y Nosotros
[4] Numero cuántico Azimutal monografias
[5] Numero cuántico Azimutal textoscientificos
[6] Inflación Cuántica textos científicos.
[7] Números cuánticos textoscientíficos.com.
[8] Inflación Cuántica Monografías
[9] Orbital Atómico
[10] Números Cuánticos.
[11] Átomo de Bohr.
[12] Líneas de Balmer.
[13] Constante Rydberg.
[14] Dilatación gravitacional del tiempo.
[15] Número Cuántico magnético.
[16] Numero Cuántico Azimutal.
Copyright © Derechos Reservados.
Heber Gabriel Pico Jiménez MD. Médico Cirujano 1985 de la Universidad de Cartagena Colombia. Investigador independiente de problemas biofísicos médicos propios de la memoria, el aprendizaje y otros entre ellos la enfermedad de Alzheimer.
Estos trabajos, que lo más probable es que estén desfasados por la poderosa magia secreta que tiene la ignorancia y la ingenuidad, sin embargo, como cualquier representante de la comunidad académica que soy, también han sido debidamente presentados sobretodo este se presentó el 30 de Junio del 2013 en la “Academia Colombiana de Ciencias Exactas, Físicas y Naturales” ACCEFYN.