Osmium of tetroxide
Por Heber Gabriel Pico Jiménez MD
Resumen
En este trabajo gracias a la nueva regla del octeto se logra demostrar el mecanismo por el cual los 8 enlaces del Osmio con los oxígenos en el tetróxido de Osmio son enlaces hipervalentes. Este compuesto es otra de esas moléculas semejantes a los fluoruros de Xenón, que también carece de aquellos enlaces covalentes ordinarios que tienen dos electrones y dos huecos. La nueva regla del octeto descubre el mecanismo de como vaciar el orbital d de los niveles anteriores a la capa de valencia en el ión permanganato, el ión cromato y el ión vanadato.
Palabras claves: Enlaces covalentes, Enlaces hipervalentes.
Abstract
In this work thanks to the new rule of byte is achieved demonstrated the mechanism by which 8 links the oxygens in osmium tetroxide with osmium are links hipervalentes. This compound is another of these molecules like fluorides of Xenon, which also lacks those ordinary Covalent bonds that have two electrons and two holes. The new rule of byte see the mechanism as empty d orbital to valencia in ion coating levels permanganate, chromate ion and the vanadate ion.
Keywords: Covalent links, links hipervalentes.
1. Introducción
Precisamos que todo el desarrollo de este artículo, estará siempre sostenido en el principio de que químicamente los electrones por lo general, estarán casi siempre apareados. Bajo este principio se desarrollan los anteriores trabajos de energía atómica Número cuántico magnético del electrón, el trabajo de la superconductividad, el artículo del acoplamiento espín-órbita del electrón, además el anterior trabajo de Semiconductores y el de Células fotoeléctricas publicado en textoscientificos y Monografías. También este artículo se basa en la nueva regla del octeto.
En la molécula de monóxido de carbono el átomo de carbono se comporta como un nucleófilo rico en electrones es decir como un carbanión.
2. Desarrollo del Tema.
El tetróxido de osmio es un solido volátil con olor a cloro identificado con la formula OsO4.
EL ÁTOMO DE OSMIO
Es un elemento químico de transición con número atómico 76, ubicado en el grupo 8 de la tabla periódica de los elementos.
El osmio puede presentar varios estados de oxidación que van desde cero hasta 8.
Es el elemento de mayor densidad en la tierra siendo de mayor densidad que el Iridio.
ESTADO FUNDAMENTAL del OSMIO
Según la nueva regla del octeto el Osmio presenta un estado fundamental y varios estados de excitaciones con la misma carga eléctrica fundamental. En el estado fundamental tiene dos electrones apareados en la última capa de valencia:
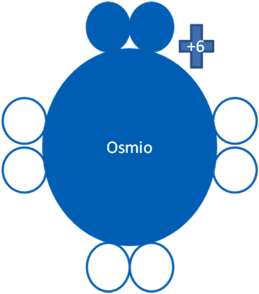
Átomos de Osmio en estado fundamental. Los pequeños círculos rellenos azul corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Osmio es de más seis (+6).
Fig. No.1
PRIMER ESTADO de EXCITACIÓN del OSMIO
El primer estado de excitación cuando el osmio intercambia partículas de huecos por electrones d. El osmio tiene dos electrones enlazantes.
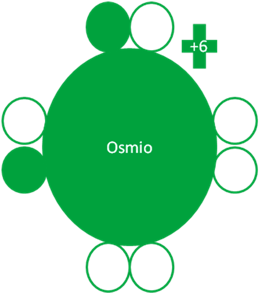
Átomo de Osmio en el primer estado de excitación. Los pequeños círculos rellenos de verde corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Osmio es de más seis (+6).
Fig. No.2
SEGUNDO ESTADO de EXCITACIÓN del OSMIO
El Osmio hace su primer intercambio de electrones por huecos como partículas quedando con 3 electrones enlazantes en su capa de valencia.
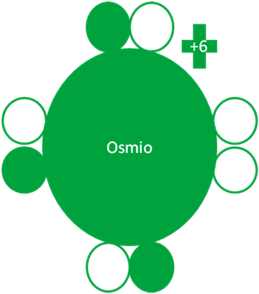
Átomos de Osmio en el segundo estado de excitación. Los pequeños círculos rellenos de verde corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Osmio es de más seis (+6).
Fig. No.3
TERCER ESTADO de EXCITACIÓN del OSMIO
El Osmio hace su segundo intercambio de partículas quedando con 4 electrones enlazantes.
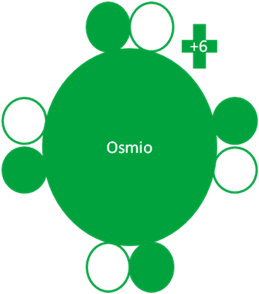
Átomos de Osmio en el tercer estado de excitación. Los pequeños círculos rellenos de verde corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Osmio es de más seis (+6).
Fig. No.4.
CUARTO ESTADO de EXCITACIÓN del OSMIO
El Osmio hace su tercer intercambio de partículas y queda con 3 electrones enlazantes y un par de electrones libres.
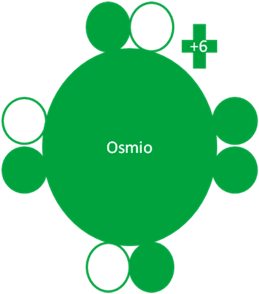
Átomos de Osmio en el cuarto estado de excitación. Los pequeños círculos rellenos de verde corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Osmio es de más seis (+6).
Fig. No.5.
QUINTO ESTADO de EXCITACIÓN del OSMIO
El osmio hace cuarto intercambio de partículas y queda con dos electrones enlazantes y dos pares de electrones libres.
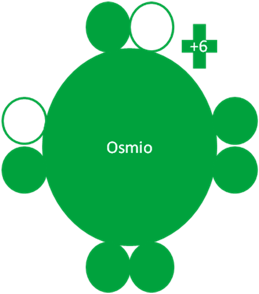
Átomos de Osmio en el quinto estado de excitación. Los pequeños círculos rellenos de verde corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Osmio es de más seis (+6).
Fig. No.6.
SEXTO ESTADO EXCITADO del OSMIO
El osmio hace su quinto intercambio de partículas y queda con un electrón enlazante y 3 pares de electrones libres.
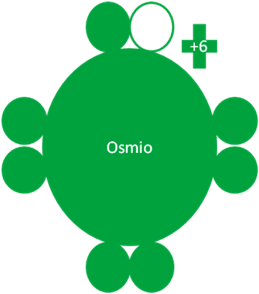
Átomos de Osmio en el sexto estado de excitación. Los pequeños círculos rellenos de verde corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Osmio es de más seis (+6).
Fig. No.7.
SEPTIMO ESTADO de EXCITACIÓN del OSMIO
El osmio hace su sexto intercambio de partículas y queda con la capa de valencia llena igual que un gas noble.
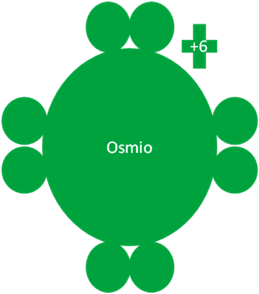
Átomos de Osmio en el séptimo estado de excitación. Los pequeños círculos rellenos de verde corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Osmio es de más seis (+6).
Fig. No.8.
En los estados de excitación los electrones ubicados en el sub orbital d es intercambiado por un hueco como partícula de la capa de valencia es decir: el hueco pasa a reemplazar al electrón en su ubicación del orbital d y el electrón pasa a ocupar la posición que tenía el electrón en la capa de valencia.
El osmio en el tetróxido de este elemento (OsO4) tiene un estado de oxidación formal de +8, siendo el más alto estado de oxidación conocido para un metal de transición.
El átomo de osmio pasa a tener 8 electrones en su capa de valencia.
El séptimo estado de excitación del osmio origina la formación del tetraóxido de osmio.
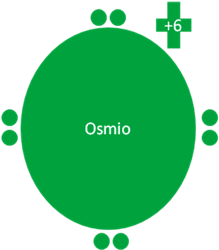
Átomo de Osmio en el séptimo estado de excitación. Los pequeños círculos rellenos de verde y azul corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Osmio es de más seis (+6).
Fig. No.9.
TETRÓXIDO DE OSMIO
Los 8 enlaces del osmio, son enlaces hipervalentes de dos electrones y un solo hueco. La carga eléctrica de los átomos no se altera, el osmio y los 4 oxígenos continúan con la misma carga de +6 y +2.
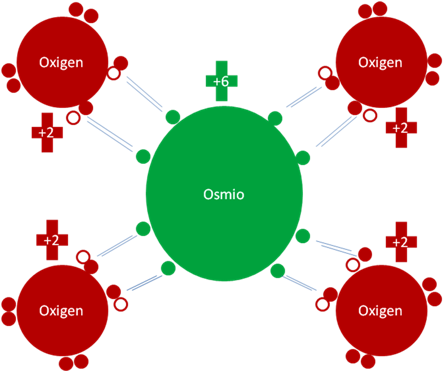
Tetróxido de Osmio. Los 8 pares de barras de color azul oscuro corresponden a 8 enlaces hipervalentes. Los pequeños círculos rellenos de verde y rojos corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Osmio es de más seis (+6) y la de los oxígenos es más dos (+2).
Fig. No.10.
Como dato curioso el osmio que en su estado fundamental cuenta con 6 huecos, en el tetróxido no se queda el osmio con ninguno de ellos en la capa de valencia, todas esas partículas las intercambian por los 6 electrones del orbital d, se puede decir que es una configuración d0 porque ese orbital queda sin electrones pero nunca queda totalmente vacío tal como se pretende aceptar.
ESTRUCTURAS TETRAÉDRICAS RELACIONADAS A LAS DEL TETRÓXIDO DE OSMIO
Existen complejos tetraédricos observados en óxidos que son electronicamente relacionadas con el tetróxido de osmio como el anión permanganato (MnO4-1), el anión cromato (CrO4-2) y el anión vanadato.
ANIÓN PERMANGANATO MnO4-1.
La capa de valencia del manganeso en su estado fundamental tiene los mismos huecos que tiene el Osmio, pero a diferencia del osmio el orbital d del manganeso solo tiene a 5 electrones, es decir al manganeso excitado le queda un hueco y 7 electrones de valencia en su estado de mayor excitación.
Ese hueco que le queda al manganeso lo usa para alterar el tipo de enlace que tiene con uno de los 3 oxígenos, lo elimina como enlace hipervalente y lo transforma en enlace covalente ordinario de dos electrones y dos huecos.
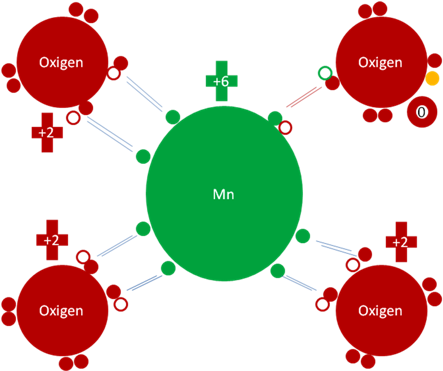
Anión Permanganato. Los 6 pares de barras de color azul oscuro corresponden a 6 enlaces hipervalentes. Al único par de barras de color rojo representan al único enlace covalente ordinario de dos electrones y dos huecos. Los pequeños círculos rellenos de verde y rojos corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del manganeso es de más seis (+6) y la de los 3 oxígenos hipervalente es más dos (+2) porque uno de los oxigenos dejo de ser ipervalente y tiene carga interna de cero (0). El pequeño y único círculo de color naranja corresponde a un electrón que ioniza a uno de los oxígenos ligados al manganeso.
Fig. No.11.
El manganeso tiene la misma carga eléctrica del osmio que es más seis (+6).
El anión permanganato tiene a 6 enlaces hipervalentes y a un solo enlace covalente ordinario de dos electrones y dos huecos.
La carga eléctrica del oxigeno ionizado y ligado al manganeso por enlace covalente ordinario es cero (0).
El electrón de color naranja en el oxígeno ionizado, es el electrón extraño que ioniza al oxígeno para volverlo con carga eléctrica de cero (0).
Ese electrón extraño color naranja es el que ha sido intercambiado con un hidrógeno que se llevó al hueco y dejo al electrón en el oxígeno ionizado.
Ele elctrón extraño es intercabiado por un hueco de algún hidrógeno por no violar la nueva regla del octeto.
ANIÓN CROMATO CrO4-2.
La capa de valencia del cromo en su estado fundamental tiene 7 huecos y un solo electrón de valencia.
Como el orbital d del cromo solo tiene a 5 electrones, entonces el estado de mayor excitación en el cromo no pasa de 6 electrones de valencia.
En su estado de mayor excitación al cromo para cumplir la nueva regla del octeto le quedan 6 electrones y dos huecos en su capa de valencia.
Esos dos huecos que le quedan al cromo en su capa de valencia, los utiliza para transformar a dos enlace hipervalente, lo tranforma en enlace covalente ordinario de dos electrones y dos huecos.
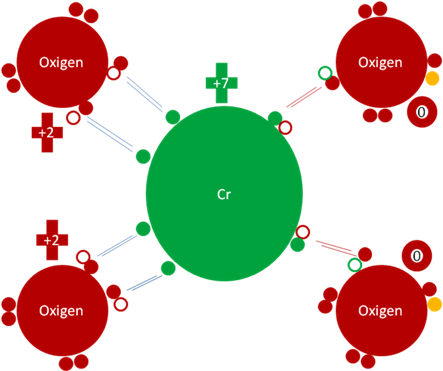
Anión Cromato. Los 4 pares de barras de color azul oscuro corresponden a 4 enlaces hipervalentes. Los dos pares de barras de color rojo representan a dos enlaces covalentes ordinarios de dos electrones y dos huecos cada uno. Los pequeños círculos rellenos de verde y rojos corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del cromo es de más siete (+7) y la de los 2 oxígenos hipervalentes es más dos (+2) pero los otros dos oxígenos tienen carga eléctrica interna de cero (0). Los dos pequeño círculos de color naranja corresponde a los electrones que ionizan a los dos oxígenos ligados al cromo.
Fig. No.12.
El cromo como tiene un solo electrón de valencia tiene la carga eléctrica de más siete (+7).
El anión cromato tiene a 4 enlaces hipervalentes y a dos enlaces covalentes ordinarios que tienen dos electrones y dos huecos.
La carga eléctrica de los dos oxígenos ionizados y ligados al cromo por enlaces covalentes ordinarios es cero (0).
El electrón de color naranja en los oxígenos ionizados, es el electrón extraño que ioniza a los oxígenos para volverlo con carga eléctrica de cero (0).
Ese electrón extraño color naranja es el que ha intercambiado cada oxígeno con un hidrógeno, que se llevó al hueco y dejo al electrón en el oxígeno ionizado.
El cromo como elementos del grupo 3 al 7, forma compuestos análogos a aquellos formados por elementos del grupo 13 al 17, como el ión sulfato SO4-2.
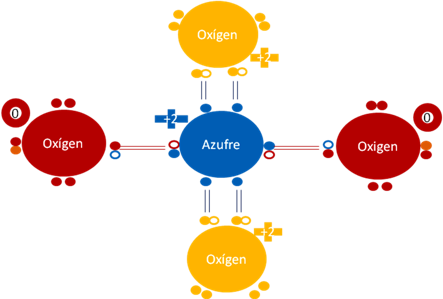
Ión Sulfato SO4-2. Los dos pares de barras de color azul oscuro corresponden a los dos enlaces hipervalentes. Los dos pares de barras de color rojo corresponden a los dos enlaces covalentes ordinarios de dos electrones y de dos huecos. Los dos oxígenos unidos por enlaces hipervalentes tienen carga eléctrica de +2. Los dos oxígenos unidos por enlace covalente ordinario de dos electrones y dos huecos tienen carga eléctrica interna de cero. El azufre central tiene carga eléctrica de +2. Los círculos pequeños rellenos de colores representan a los electrones del átomo del mismo color. Los círculos pequeños y vacíos representan a los huecos. Los dos pequeños círculos rellenos de color naranja oscuro corresponden a dos electrones de dos hidrógenos que los intercambiaron por los huecos de los dos oxígenos ionizados.
Figuraa No.13.
ANIÓN VANADATO VO4-3.
La capa de valencia del Vanadio en su estado fundamental tiene 6 huecos y dos electrones de valencia.
Como el orbital d del Vanadio tiene solo a 3 electrones, entonces el estado de mayor excitación en el vanadio no pasa de 5 electrones de valencia.
En su estado de mayor excitación al vanadio para cumplir la nueva regla del octeto le quedan 5 electrones y 3 huecos en su capa de valencia.
Esos 3 huecos que le quedan al vanadio en su capa de valencia, los utiliza para hacer dos enlaces hipervalentes y 3 enlaces covalentes ordinarios de dos electrones y dos huecos.
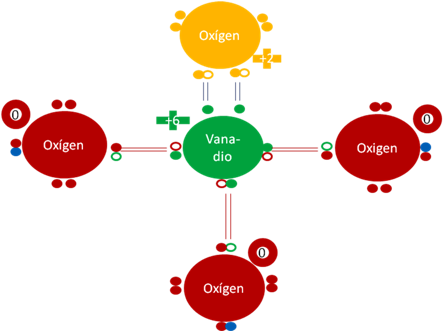
Ión Vanadato VO4-3. Los dos pares de barras de color azul oscuro corresponden a los dos únicos enlaces hipervalentes. Los tres pares de barras de color rojo corresponden a los 3 enlaces covalentes ordinarios de dos electrones y de dos huecos. El oxígeno unido por los dos enlaces hipervalentes tiene carga eléctrica de +2. Los 3 oxígenos unidos por enlaces covalente ordinario de dos electrones y dos huecos tienen carga eléctrica interna de cero. El vanadio central tiene carga eléctrica de +6. Los círculos pequeños rellenos de colores representan a los electrones del átomo del mismo color. Los círculos pequeños y vacíos representan a los huecos de cada átomo que tenga el mismo color de línea. Los 3 pequeños círculos rellenos de color azul corresponden a 3 electrones de 3 hidrógenos que los intercambiaron por los huecos de los 3 oxígenos ionizados.
Figuraa No.14.
El Vanadio fundamental como tiene dos electrones de valencia, tiene la carga eléctrica de más seis (+6).
El anión vanadiato tiene a 2 enlaces hipervalentes y a tres enlaces covalentes ordinarios que tienen dos electrones y dos huecos.
La carga eléctrica de los tres oxígenos ionizados y ligados al vanadio por enlaces covalentes ordinarios es cero (0).
Los electrones de color azul ubicados en los oxígenos ionizados, son los electrones extraños que ionizan a los oxígenos para volverlo con carga eléctrica de cero (0).
Esos electrones extraños de color azul son los que se han intercambiado cada oxígeno con un hidrógeno, quienes se llevaron los huecos y dejaron los electrones en los oxígenos ionizados.
El Vanadio como elementos del grupo 3 al 7, forma compuestos análogos a aquellos formados por elementos del grupo 13 al 17, como el ión foslfato PO4-3.
El átomo de fosforo no necesita utilizar electrones ubicados en el orbital d del anterior nivel de energía.
Los aniones parecen tener mucha mayor estabilidad que los mismos compuestos no ionizados.
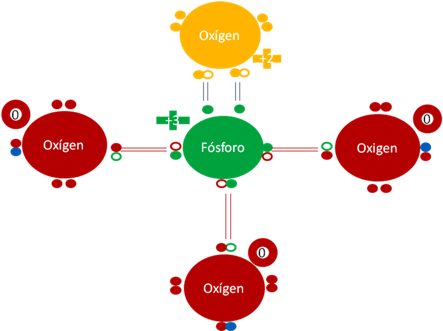
Ión Fosfato PO4-3. Los dos pares de barras de color azul oscuro corresponden a los dos únicos enlaces hipervalentes. Los tres pares de barras de color rojo corresponden a los 3 enlaces covalentes ordinarios de dos electrones y de dos huecos. El oxígeno unido por los dos enlaces hipervalentes tiene carga eléctrica de +2. Los 3 oxígenos unidos por enlaces covalente ordinario de dos electrones y dos huecos tienen carga eléctrica interna de cero. El fósforo central tiene carga eléctrica de +3. Los círculos pequeños rellenos de colores representan a los electrones del átomo del mismo color. Los círculos pequeños y vacíos representan a los huecos de cada átomo que tenga el mismo color de línea. Los 3 pequeños círculos rellenos de color azul corresponden a 3 electrones de 3 hidrógenos que los dejaron intercambiados por los huecos de los 3 oxígenos ionizados.
Figuraa No.14.
ACLARACIONES:
a) Estas figuras del tetraóxido de osmio, el ión permanganato, el ión cromato, el ión vanadato, el ión sulfato y el ión fosfato, por conveniencia y facilidad, se desriben en un solo plano pero en 3 dimensiones tienen formas tetraédricas.
b) Otra aclaración es que el fenómeno de la resonancia se explica por el “Mecanismo de Berry”.
3- Conclusiones:
1- LA PRIMERA GRAN CONCLUSIÓN de este artículo es que en realidad, los huecos revolucionan a la fisicoquímica, por las grandes repercusiones que tiene en la carga eléctrica de los átomos en las moléculas. Si bien es cierto que este artículo es solo teoría y que hace falta sobretodo probar en unos semiconductores propuesto en el trabajo de células fotoeléctricas. Además hay fenómenos indiscutibles, como son la identificación de dos tipos de enlaces covalentes en las moléculas hipervalentes, la descripción de los iones divalentes de plomo, etc., etc. Es probable también que el hueco como partícula, explique las anomalías en la configuración electrónica que tienen los elementos de transición.
2- LA SEGUNDA GRAN CONCLUSIÓN de este trabajo es la confirmación de la “Nueva regla del octeto” quien sostiene que todos los átomos, están rodeados por su capa de valencia que está conformada por 8 partículas, esas partículas están constituidas por electrones y huecos.
4- Referencias
REFERENCIAS DEL ARTÍCULO.
[1] Enlaces en moléculas Hipervalentes
[2] Nueva regla del octeto
[3] Estado fundamental del átomo
[4] Estado fundamental del átomo
[5] Barrera rotacional del etano.
[6] Enlaces de uno y tres electrones.
[7] Enlaces de uno y tres electrones.
[8] Origen de la barrera rotacional del etano
[9] Monóxido de Carbono
[10]Nueva regla fisicoquímica del octeto
[11]Células fotoeléctricas Monografías.
[12]Células Fotoeléctricas textoscientificos.
[13]Semiconductores Monografías.
[14]Semiconductores textoscientificos.
[15]Superconductividad.
[16]Superconductividad.
[17]Alotropía.
[18]Alotropía del Carbono.
[19]Alotropía del Oxigeno.
[20]Ozono.
[21]Diborano
[22]Semiconductores y temperatura.
REFERENCIAS DE LA TEORÍA
[1] Número cuántico magnético.
[2] Ángulo cuántico
[3] Paul Dirac y Nosotros
[4] Numero cuántico Azimutal monografias
[5] Numero cuántico Azimutal textoscientificos
[6] Inflación Cuántica textos científicos.
[7] Números cuánticos textoscientíficos.com.
[8] Inflación Cuántica Monografías
[9] Orbital Atómico
[10] Números Cuánticos.
[11] Átomo de Bohr.
[12] Líneas de Balmer.
[13] Constante Rydberg.
[14] Dilatación gravitacional del tiempo.
[15] Número Cuántico magnético.
[16] Numero Cuántico Azimutal.
Copyright © Derechos Reservados.
Heber Gabriel Pico Jiménez MD. Médico Cirujano 1985 de la Universidad de Cartagena Colombia. Investigador independiente de problemas biofísicos médicos propios de la memoria, el aprendizaje y otros entre ellos la enfermedad de Alzheimer.
Estos trabajos, que lo más probable es que estén desfasados por la poderosa magia secreta que tiene la ignorancia y la ingenuidad, sin embargo, como cualquier representante de la comunidad académica que soy, también han sido debidamente presentados sobretodo este se presentó el 10 de Septiembre del 2013 en la “Academia Colombiana de Ciencias Exactas, Físicas y Naturales” ACCEFYN.