Chlorine Dioxide
Heber Gabriel Pico Jiménez MD
Resumen
La nueva regla del octeto Predice la existencia de cuatro enlaces hipervalentes en la molécula de Dióxido de cloro. Con esta predicción se da una explicación al desconcierto que han tenido los químicos con la estructura electrónica de dicha molécula. El dióxido de cloro es un molécula especial porque no encaja con la teoría de los enlaces de tres electrones ni en los supuestos enlaces hipervalentes de tres (3) centros con cuatro (4) electrones. La base del desconcierto ha sido la vacía predisposición académica permanente de querer suponer en la molécula, algo que es improbable como lo es un enlace de tres electrones. Esta preferencia se ha manejado casi como un principio que lo que hace es preparar la suposición de que el dióxido de cloro, no es una molécula hipervalente. No se han dado cuenta que así como el cloro configura con el Flúor a dos enlaces hipervalentes en el trifluoruro de cloro, enlaces que incluso no son coaxiales ni colineales porque aunque es leve, tienen cierto grado de flexión. Pues así como con el flúor, también con el oxígeno el cloro configura enlaces pero esta vez paralelos con 90 grados de flexión formando moléculas hipervalentes como los cloritos, los cloratos, los percloratos, el trióxido de dicloro y el ácido cloroso. La resistencia que ha tenido la academia para aceptar como hipervalentes a ciertos enlaces dobles con el átomo de oxígeno, es porque esos enlaces dobles con el anfígeno, son paralelas y tienen 90 grados de giro y como no son coaxiales, no encajan en otra también improbable suposición teórica que son los supuestos enlaces necesariamente coolienales y coaxiales de tres centros con cuatro electrones.
Palabras claves: Hipervalencia, Nueva regla del Octeto.
Abstract
The new rule byte predicts the existence of four hipervalentes bonds in the molecule of chlorine dioxide. With this prediction an explanation is given to the uncertainty that have had chemicals with the electronic structure of this molecule. Chlorine dioxide is a special molecule because it does not fit in the links of three electrons or 3 centers hipervalentes alleged links with 4 electrons. The basis of the confusion has been empty academic predisposition permanent wish to assume in the molecule, which is unlikely as it is a link of three electrons. This preference has been managed almost as a principle that it does is prepare the assumption that chlorine dioxide, is a hypervalent molecule. They have not realized that as well as chlorine configured with fluorine to two links hipervalentes in links chlorine trifluoride even non coaxial or collinear because although it is mild, they have some degree of bending. As well as with fluorine, also with oxygen chlorine set up links but this parallel time with 90 degrees of flexion forming molecules hipervalentes chlorites, dichlorine trioxide, the Perchlorates, chlorates and chlorous acid. The resistance that the Academy had to accept as hipervalentes to certain double bonds with the oxygen atom, is because those double bonds with the chalcogen, are 90 degrees of rotation and as non-coaxial, do not fit into another also unlikely theoretical that are alleged links necessarily colienales and coaxial assumption of three centres with four electrons.
Keywords: Hipervalencia, new rule of byte.
1. Introducción
Precisamos que todo el desarrollo de este artículo, estará siempre sostenido en el principio de que químicamente los electrones por lo general, estarán casi siempre apareados. Bajo este principio se desarrollan los anteriores trabajos de energía atómica Número cuántico magnético del electrón, el trabajo de la superconductividad, el artículo del acoplamiento espín-órbita del electrón, además el anterior trabajo de Semiconductores y el de Células fotoeléctricas publicado en textoscientificos y Monografías. También este artículo se basa en la nueva regla del octeto.
En la molécula de monóxido de carbono el átomo de carbono se comporta como un nucleófilo rico en electrones es decir como un carbanión.
Este trabajo está basado en el del estado fundamental del átomo y los enlaces hipervalentes. Además se encuentra el artículo Pentafluoruro de Antimonio.
2. Desarrollo del Tema.
ÁTOMO DE CLORO
El cloro es un elemento químico de número atómico 17 situado en el grupo 17 de los halógenos en la tabla periódica de los elementos
En condiciones normales y en estado puro forma moléculas diatómicas que es un gas tóxico amarillo verdoso.
Por su ubicación en el grupo 17 de la tabla periódica tiene a 7 electrones de valencia.
El átomo de cloro como halógeno que es, igual que los alcalinos el estado fundamental es el mismo estado excitado pero con la carga eléctrica de más uno (+1)
ESTADO FUNDAMENTAL y EXCITADO del ÁTOMO de CLORO
Según la nueva regla del octeto el cloro presenta un estado fundamental, que es el mismo estado excitado, el cual tiene tres pares de electrones libres y un electrón enlazante apareado con un hueco.
Cuando un electrón se encuentra apareado con un hueco se convierte en un electrón enlazante por lo tanto, el estado fundamental y excitado del cloro tiene a un solo electrón enlazante.
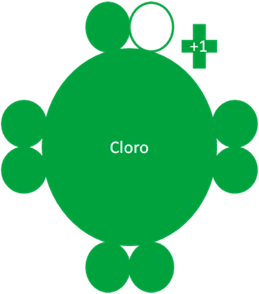
Átomo de cloro en el único estado fundamental y excitado. Los pequeños círculos rellenos verde corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del cloro es de más uno (+1).
Fig. No1.
Como el átomo de cloro el estado fundamental es el mismo estado excitado, entonces el mismo estado tiene a tres herramientas a) Por un lado tiene la primera herramienta de utilizar solo al electrón enlazante que es el electrón apareado con un hueco. b) La segunda herramienta que es trabajar de forma complementaria tanto con los pares libres de electrones no enlazantes y también usar al único electrón enlazante que es el único electrón que está apareado con un hueco y c) La tercera herramienta que es de utilizar solo a los pares libres de electrones no enlazantes, en esta tercera opción, no se utiliza al electrón enlazante que se deja totalmente libre.
ÁTOMO de CLORO UTILIZANDO SOLO al ELECTRÓN ENLAZANTE que está APAREADO con un HUECO (PRIMERA OPCIÓN)
Cuando el átomo de Cloro usa en las moléculas, solo al electrón enlazante, que es el electrón que está apareado con un hueco, forma compuestos como el cloruro de sodio (NaCl), el cloruro de hidrógeno (HCl), el monóxido de cloro, los hipocloritos (ClO-1) y el ácido hipocloroso (HClO).
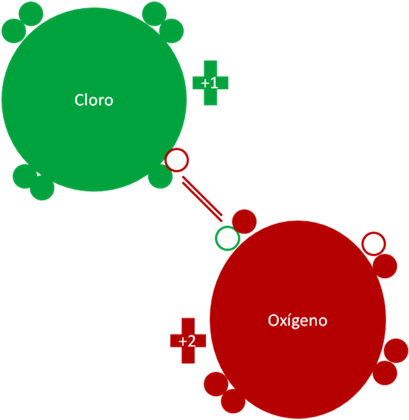
Monóxido de cloro como agente oxidante. El par de barras de color rojo representan al enlace covalente ordinario de dos electrones y dos huecos. Los pequeños círculos rellenos de colores representan a los electrones del átomo del mismo color. Los pequeños círculos vacíos corresponden a los huecos del átomo que tiene el mismo color de línea. La carga eléctrica del cloro es más uno (+1) y la carga eléctrica del oxigeno es más dos (+2).
Figura 2.
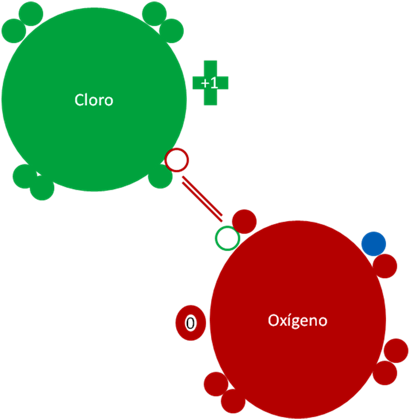
Monóxido de cloro en estado reducido. El par de barras de color rojo representan al enlace covalente ordinario de dos electrones y dos huecos. Los pequeños círculos rellenos de colores representan a los electrones del átomo del mismo color. Los pequeños círculos vacíos corresponden a los huecos del átomo que tiene el mismo color de línea. El pequeño círculo relleno de azul corresponde al electrón reductor. La carga eléctrica del cloro es más uno (+1) y la carga eléctrica del oxigeno es cero (0).
Figura No3.
ÁTOMO de CLORO UTILIZANDO a LOS PARES de ELECTRONES LIBRES y TAMBIÉN al ELECTRÓN ENLAZANTE (SEGUNDA OPCIÓN)
Cuando el átomo de cloro en las moléculas usa tanto los pares libres de electrones no enlazantes, como también al único electrón enlazante, forma moléculas como los cloritos y el ácido cloroso, los cloratos y el ácido clórico, los percloratos con su ácido perclórico y el trióxido de dicloro (Cl2O3) entre otros.
ÁTOMO de CLORO UTILIZANDO SOLO a los PARES DE ELECTRONES LIBRES o ELECTRONES NO ENLAZANTES (TERCERA OPCIÓN)
Cuando el átomo de cloro forma moléculas usando solo a los pares libres de electrones no enlazantes, forma moléculas como el Dióxido de cloro.
La estructura electrónica del Dióxido de cloro, ha desconcertado la comunidad científica que tiene que ver con esta disciplina.
Las estructuras de Lewis no presentan los argumentos teóricos necesarios para comprender al Dióxido de cloro y mucho menos la teoría de orbitales moleculares.
DIÓXIDO DE CLORO HIPERVALENTE como AGENTE OXIDANTE
Veamos que es una decisión química el hecho de que más del 95% del dióxido de cloro, que se produce hoy en el mundo, está hecho a partir del clorato de sodio.
El átomo de cloro tiene a un solo electrón apareado con un hueco y un solo electrón enlazante.
Es el único electrón capaz de configurar un enlace covalente ordinario que esté constituido por dos electrones y dos huecos.
El átomo de cloro tiene tres (3) pares de electrones libres, que son seis (6) electrones capaces de configurar a seis (6) enlaces hipervalentes.
Al cloro no le ocurre lo mismo que le ocurre al azufre en el dióxido de azufre que puede hacer con el mismo oxígeno, un enlace covalente ordinario y un enlace hipervalente.
El átomo de cloro configura entonces, dos enlaces hipervalentes con cada uno de los dos oxígeno, para un total de 4 enlaces hipervalentes en el dióxido de cloro.
Le queda entonces un par de electrones libres y además, le queda sin usar, un electrón enlazante que es aquel electrón que está apareado con un hueco.
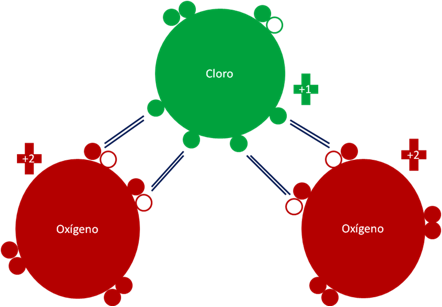
Dióxido de Cloro como agente oxidante. Los cuatro (4) pares de barras de color azul oscuro representan a los cuatro (4) únicos enlaces que son hipervalentes. Los pequeños círculos rellenos de verde y rojo corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del átomo de cloro es de más uno (+1). La carga eléctrica de los átomos de oxígenos es de más dos (+2).
Fig. No.4.
DIÓXIDO de CLORO HIPERVALENTE en ESTADO REDUCIDO
El dióxido de cloro puede quedar en la forma tal como está en la figura anterior, o también se reduce ganándole iónicamente un electrón a otra molécula que oxide.
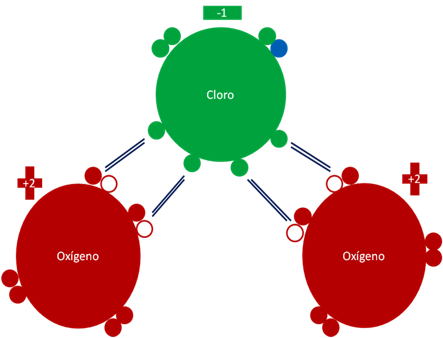
Dióxido de cloro reducido. Los cuatro (4) pares de barras de color azul oscuro representan a los cuatro (4) únicos enlaces que son hipervalentes. Los pequeños círculos rellenos de verde y rojo corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del átomo de cloro es de menos uno (-1). La carga eléctrica de los átomos de oxígenos es de más dos (+2). El pequeño círculo relleno de color azul representa al electrón que ioniza al cloro para volver paramagnético al dióxido de cloro.
Fig. No.5.
COMPARACIÓN del DIÓXIDO de CLORO con el DIÓXIDO de AZUFRE HIPERVALENTE
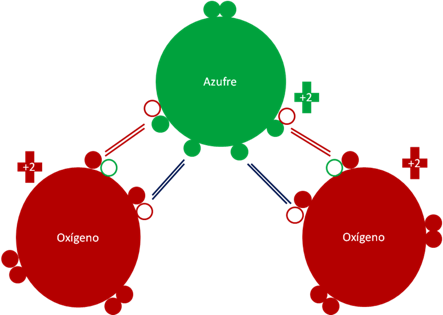
Dióxido de Azufre. Los dos pares de barras de color rojo representan a dos (2) enlaces covalentes compuestos por dos electrones y dos huecos. Los dos (2) pares de barras de color azul oscuro representan a los dos (2) enlaces hipervalentes. Los pequeños círculos rellenos de verde y rojo corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Azufre es de más dos (+2). La carga eléctrica de los átomos de oxígeno es también de más dos (+2).
Fig. No.6.
COMPARACIÓN del DIÓXIDO del CLORO y del AZUFRE con el OZONO OXIDANTE
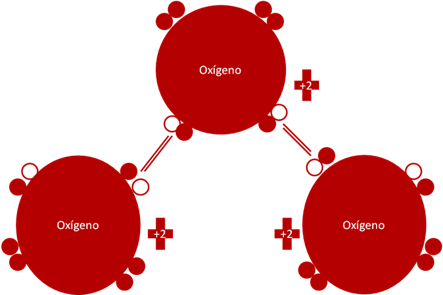
Molécula de Ozono como agente oxidante. Los dos pares de barras de color rojo representan a dos (2) enlaces covalentes compuestos por dos electrones y dos huecos. Los pequeños círculos rellenos de rojo corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica de los 3 oxígeno es de más dos (+2) para cada uno.
Fig. No.7.
COMPARACIÓN del DIÓXIDO de CLORO y del AZUFRE con el OZONO REDUCIDO
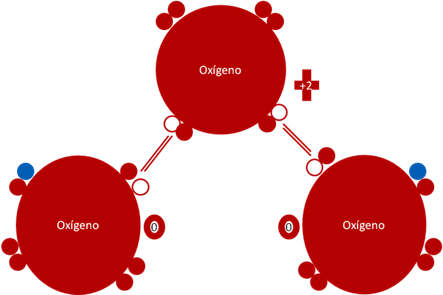
Molécula de Ozono en estado reducido. Los dos pares de barras de color rojo representan a dos (2) enlaces covalentes compuestos por dos electrones y dos huecos. Los pequeños círculos rellenos de rojo corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del oxígeno central es de más dos (+2). Los oxígeno laterales tiene carga eléctrica de cero (0) para cada uno.
Fig. No.8.
LA CONFUSIÓN DE LOS QUIMICOS
La pregunta de por qué el desconcierto de los químicos en la estructura electrónica del dióxido de cloro, pues esa pregunta nosotros le tenemos una explicación.
La forma como se sintetiza el dióxido de cloro, por un lado se sintetiza en el laboratorio a partir de lo que parece la sola oxidación del clorito de sodio. Por el otro lado se sintetiza con una alta eficiencia a gran escala en el mundo, a partir de la reducción del clorato de sodio en una solución ácida fuerte, con un adecuado agente reductor tal como el metanol.
Resulta que en la síntesis a partir de la oxidación del clorito de sodio, se tiene que transitar por la vía del clorato de sodio, porque se hace una oxidación y a la vez se efectúa una reducción.
La estructura electrónica del dióxido de cloro ha desconcertado a los químicos, porque todas las posibles estructuras alzan vuelo con la intervención de un enlace de tres electrones.
Los químicos no piensan en los enlaces hipervalentes porque esperan que sean enlaces hipervalentes axiales que cumplan la teoría de los 3 centros y 4 electrones, sin embargo la nueva regla del octeto sostiene enlaces hipervalentes paralelos y en el dióxido de cloro, no tiene validez la teoría de los enlaces de tres centros y 4 electrones.
La nueva regla del octeto le soluciona el problema de la incertidumbre que tienen los químicos en el dióxido de cloro.
Vamos a referirnos de forma independientes a las estructuras electrónicas del anión clorito y el anión clorato:
ANIÓN CLORITO HIPERVALENTE y REDUCIDO ClO2-1.
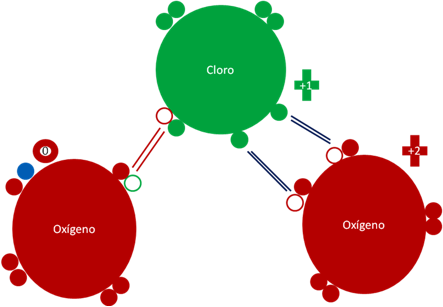
Anión clorito reducido. Los dos (2) pares de barras de color azul oscuro representan a dos (2) enlaces hipervalentes. El único par de barras de color rojo representan al único enlace covalente ordinario conformado por dos electrones y dos huecos. Los pequeños círculos rellenos de distintos colores rojo y verde representan a los electrones del átomo que tiene su mismo color. Los círculos pequeños y vacios representan a los huecos del átomo que tiene su mismo color de línea. El pequeño círculo relleno de color azul representan al electrón del sodio que ioniza a unos de los oxígenos. La carga eléctrica del oxígeno ionizado de la izquierda es de cero (0) mientras la carga eléctrica del oxigeno de la derecha es de más 2 (+2).
Figura No.9.
Si este anión clorito de la figura anterior, si lo queremos oxidar con seguridad vamos a obtener es al clorato.
ANIÓN CLORATO HIPERVALENTE y REDUCIDO ClO3-1.
La reducción de los cloratos conlleva la producción del dióxido de cloro.
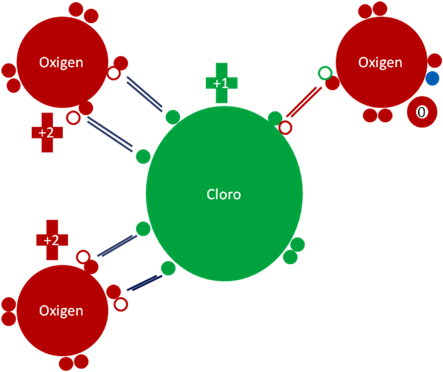
Anión clorato reducido. Los cuatro (4) pares de barras de color azul oscuro representan a los cuatro (4) enlaces hipervalentes. El único par de barras de color rojo representa al único enlace covalente ordinario que utiliza a dos electrones y a dos huecos. Los pequeños círculos rellenos de distintos colores rojo y verde representan a los electrones del átomo que tiene su mismo color. Los círculos pequeños y vacios representan a los huecos del átomo que tiene su mismo color de línea. El pequeño círculo relleno de color azul representan al electrón del sodio que ioniza a unos de los oxígenos. La carga eléctrica del cloro es de más uno (+1). La carga eléctrica de los oxígenos no ionizados es de más dos (+2). La carga eléctrica del oxigeno ionizado es de cero (0).
Figura No. 10.
3- Conclusiones:
1- LA PRIMERA GRAN CONCLUSIÓN de todos estos artículos es que en realidad, los huecos revolucionan a la fisicoquímica, por las grandes repercusiones que tiene en la carga eléctrica de los átomos en las moléculas. Si bien es cierto que este artículo es solo teoría y que hace falta sobretodo probar en unos semiconductores propuesto en el trabajo de células fotoeléctricas. Además hay fenómenos indiscutibles, como son la identificación de dos tipos de enlaces covalentes en las moléculas hipervalentes, la descripción de los iones divalentes de plomo, etc., etc. Es probable también que el hueco como partícula, explique las anomalías en la configuración electrónica que tienen los elementos de transición.
2- LA SEGUNDA GRAN CONCLUSIÓN de este trabajo es la confirmación de la “Nueva regla del octeto” quien sostiene que todos los átomos, están rodeados por su capa de valencia que está conformada por 8 partículas, esas partículas están constituidas por electrones y huecos.
3- ESTA ES LA GRAN CONCLUSIÓN DE ESTE TRABAJO. Este trabajo es la prueba más interesante que tiene la teoría de la nueva regla del octeto.
Además de la anterior predicción de las células fotoeléctricas también agregamos la predicción de la existencia de las dos moléculas distintas que son el PENTAFLUORURO de ANTIMONIO BIPIRAMIDAL TRIGONAL y el PENTAFLUORURO de ANTIMONIO PIRAMIDADAL CUADRADO.
4- CUARTA GRAN CONCLUSIÓN Es la relación de la orientación que tienen los más largos enlaces hipervalentes con los más cortos enlaces covalentes ordinarios, en el anión hexafluoruro de antimonio, es inversa a la relación que guardan esos mismos enlaces en el pentafluoruro de antimonio bipiramidal trigonal sin embargo, en el pentafluoruro de antimonio de orientación piramidal cuadrada es homologa a la del superácido.
5- UNA QUINTA GRAN CONCLUSIÓN es la prueba de que en realidad los átomos existen en estado fundamental y en estados excitados. El único átomo que tiene un estado semiexcitado adicional, es el átomo de carbono.
6- UNA SEXTA GRAN CONCLUSIÓN es que el anión fluoruro (F-1) que libera el fluoruro de hidrógeno, no es simplemente secuestrado, ni mucho menos se ocupan de él varias moléculas de pentafluoruro de antimonio, es solo una molécula de SbF5 de forma piramidal cuadrada la que reaccionan con un anión F-1, establecen entre sí un enlace coordinado donde el flúor es el dador de electrones para producir al reconocido anión hexafluoruro de antimonio octaédrico (SbF6-1).
7- UNA SEPTIMA GRAN CONCLUSIÓN es la predicción que hace este trabajo, del enlace de coordinación que se origina entre el F-1 que libera el ácido HF y el átomo de antimonio.
8- OCTAVA GRAN CONCLUSIÓN de este trabajo es la predicción del mecanismo como se identifica el camino que recorre el electrón del hidrógeno para llegar al átomo de antimonio.
9- NOVENA GRAN CONCONCLUSIÓN es la identificación que se hace en este trabajo, es precisamente la identificación de que el átomo de flúor que libera el fluoruro de hidrógeno, exactamente es el flúor que efectúa el segundo enlace axial corto, que es un enlace covalente ordinario que consta de dos electrones y dos huecos y que es distinto a los 4 enlaces que encuentra hipervalentes y ecuatoriales.
10- DECIMA GRAN CONCLUSIÓN DE ESTE TRABAJO es que para definir un ácido de Lewis, no basta con solo decir que es aquel que tiene un octeto incompleto, sino en cambio es aquel que tiene un par de huecos libres, lo mismo que decir que una base de Lewis, es aquella que por lo menos tiene un par de electrones libres.
11- UNA DECIMOPRIMERA GRAN CONCLUSIÓN DE ESTE TRABAJO es que definitivamente el enlace hipervalente tiene a tres partículas, dos electrones y un solo hueco pero no es un hueco como hueco sino como partícula.
4- Referencias
REFERENCIAS DEL ARTÍCULO.
[1] Pentafluoruro de Antimonio.
[2] Pentafluoruro de Antimonio.
[3] Tetróxido de Osmio
[4] Enlaces Hipervalentes
[5] Enlaces en moléculas Hipervalentes
[6] Nueva regla del octeto
[7] Estado fundamental del átomo
[8] Estado fundamental del átomo
[9] Barrera rotacional del etano.
[10]Enlaces de uno y tres electrones.
[11]Enlaces de uno y tres electrones.
[12]Origen de la barrera rotacional del etano
[13]Monóxido de Carbono
[14]Nueva regla fisicoquímica del octeto
[15]Células fotoeléctricas Monografías.
[16]Células Fotoeléctricas textoscientificos.
[17]Semiconductores Monografías.
[18]Semiconductores textoscientificos.
[19]Superconductividad.
[20]Superconductividad.
[21]Alotropía.
[22]Alotropía del Carbono.
[23]Alotropía del Oxigeno.
[24]Ozono.
[25]Diborano
[26]Semiconductores y temperatura.
REFERENCIAS DE LA TEORÍA
[1] Número cuántico magnético.
[2] Ángulo cuántico
[3] Paul Dirac y Nosotros
[4] Numero cuántico Azimutal monografias
[5] Numero cuántico Azimutal textoscientificos
[6] Inflación Cuántica textos científicos.
[7] Números cuánticos textoscientíficos.com.
[8] Inflación Cuántica Monografías
[9] Orbital Atómico
[10] Números Cuánticos.
[11] Átomo de Bohr.
[12] Líneas de Balmer.
[13] Constante Rydberg.
[14] Dilatación gravitacional del tiempo.
[15] Número Cuántico magnético.
[16] Numero Cuántico Azimutal.
Copyright © Derechos Reservados.
Heber Gabriel Pico Jiménez MD1. Médico Cirujano 1985 de la Universidad de Cartagena Colombia. Investigador independiente de problemas biofísicos médicos propios de la memoria, el aprendizaje y otros entre ellos la enfermedad de Alzheimer.
Estos trabajos, que lo más probable es que estén desfasados por la poderosa magia secreta que tiene la ignorancia y la ingenuidad, sin embargo, como cualquier representante de la comunidad académica que soy, también han sido debidamente presentados sobretodo este se presentó el 22 de Septiembre del 2013 en la “Academia Colombiana de Ciencias Exactas, Físicas y Naturales” ACCEFYN.