Fluoroantimonic acid
Por Heber Gabriel Pico Jiménez MD
Resumen
En este trabajo gracias a la nueva regla del octeto se logra describir la estructura molecular y electrónica de los productos encontrados en la mezcla del fluoruro de hidrógeno y el pentafluoruro de antimonio. Esos productos que a pesar de que han sido analizados por cristalografía de rayos X, no se ha definido su estructura molecular pues, la nueva regla del octeto lo ha logrado, ha podido describir los cationes [H2F]+1 y [H3F2]+1 y además el anión [Sb2F11]-1 del ácido fluoroantimónico.
Gracias a la nueva regla del octeto se logra demostrar que en los enlaces hipervalentes, existe la transferencia eléctrica equivalente a medio (½) electrón del átomo central hacia los ligandos, es por eso que el átomo central los configura es por pares con el fin de lograr transferir totalmente a un solo fermión.
Gracias a la nueva regla del octeto también se logra demostrar que en los enlaces de uno (1) y tres (3) electrones, existe la transferencia eléctrica equivalente de un electrón entre un átomo y otro, tal como en el caso de los dopajes tipo N y los dopajes tipo P de los semiconductores.
A sí mismo gracias a la nueva regla del octeto se alcanza demostrar que en los enlaces de coordinación igual que en los enlaces iónicos, existe entre átomos la transferencia eléctrica equivalente a dos (2) electrones.
Se demuestra que el único enlace químico que siempre respeta la carga eléctrica de los átomos participantes, es el enlace covalente compartido que consta de dos electrones y dos huecos como partículas.
Palabras claves: Ácido Fluoroantimónico, Superácido.
Abstract
In this work thanks to the new rule of byte is done describing the molecular and electronic structure of products found in the mixture of hydrogen fluoride and antimony pentafluoride. Those products that while they have been analyzed by x-ray crystallography, is not defined its molecular structure as the new rule of the octet has succeeded has been able to describe the cations [H2F]+1 and [H3F2]+1 in addition, the fluoroantimonic acid anion [Sb2F11]-1. Thanks to the new rule of byte is achieved to demonstrate that there is equivalent to medium power transfer in the links hipervalentes, (½) electron from one atom to another, is that the central atom set them by pairs to achieve yield totally to a single fermion. Thanks to the new rule of byte also manages to show that the links of three (3) electrons, electric transfer equivalent of an electron from one atom to another such as the doping there is N type semiconductors. Also thanks to the new rule of byte is shown in the links of a single electron, there is electrical transfer equivalent to a single electron from one atom to another as happens in the doping of semiconductor P-type. Himself thanks to the new rule of byte is reached demonstrate that coordination links and ionic bonds, there is power equivalent to two (2) electron transfer between atoms. Shows that the only chemical bond that respects the electrical charge of the participating atoms is Covalent sharing of two electrons and two holes as particles.
Keywords: Fluoroantimonic acid, Superacid.
1. Introducción
Precisamos que todo el desarrollo de este artículo, estará siempre sostenido en el principio de que químicamente los electrones por lo general, estarán casi siempre apareados. Bajo este principio se desarrollan los anteriores trabajos de energía atómica Número cuántico magnético del electrón, el trabajo de la superconductividad, el artículo del acoplamiento espín-órbita del electrón, además el anterior trabajo de Semiconductores y el de Células fotoeléctricas publicado en textoscientificos y Monografías. También este artículo se basa en la nueva regla del octeto.
En la molécula de monóxido de carbono el átomo de carbono se comporta como un nucleófilo rico en electrones es decir como un carbanión.
Este trabajo está basado en el del estado fundamental del átomo y los enlaces hipervalentes.
2. Desarrollo del Tema.
Es indudable que el ácido fluoroantimónico es el producto de la mezcla del fluoruro de hidrógeno con el pentafluoruro de antimonio, pero esa combinación no continua como una simple mezcla porque de acuerdo a las proporciones de los componentes ocurren reacciones químicas aun dudosas.
Los componentes más elementales que proporciona el experimento a la mezcla son el anión fluoruro (F-1), el catión hidrogenión (H+9) y la molécula de pentafluoruro de antimonio.
Es probable que en el medio ácido que ocasiona el fluoruro de hidrógeno el pentafluoruro de antimonio tipo bipiramidal, se convierta al instante en pentafluoruro de antimonio del tipo piramidal cuadrado.
Posteriormente, dos moléculas del pentafluoruro de antimonio tipo piramidal cuadrado, reaccionan con un solo anión fluoruro (F-1) formando al anión [Sb2F11]-1 [Sb2F11]-1.
Con una mezcla en proporción 1:1, al reaccionar dos moléculas de pentafluoruro de antimonio con un anión fluoruro, quedaría desocupado un hidrogenión (H+9) y una molécula de fluoruro de hidrógeno (HF), que también reaccionarían formando al catión [H2F]+1.
Posteriormente se encontrarían esos aniones poliatómicos y formarían a la sal de la fórmula [H2F]+1[Sb2F11]-1.
Pues casualmente en este trabajo de forma precisa nos vamos a referir especialmente, de cómo ocurre todo este proceso.
ÁTOMO de ANTIMONIO
El antimonio es un elemento químico de número atómico 51 situado en el grupo 15 de la tabla periódica de los elementos
Por su ubicación en el grupo 15 de la tabla periódica tiene a 5 electrones de valencia.
El átomo de Antimonio tiene un estado fundamental y un estado excitado con la carga eléctrica de más tres (+3).
ESTADO FUNDAMENTAL del ÁTOMO de ANTIMONIO
Según la nueva regla del octeto el Antimonio presenta un estado fundamental con la carga eléctrica de más tres (+3) el cual presenta a dos pares de electrones libres, un par de huecos libres y un electrón apareado con un hueco.
Cuando un electrón se encuentra apareado con un hueco se convierte en un electrón enlazante por lo tanto, el estado fundamental tiene a un solo electrón enlazante.
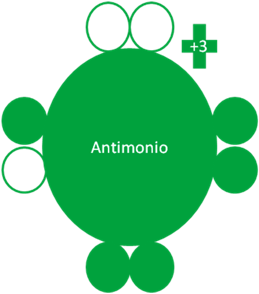
Átomo de Antimonio en estado fundamental con la carga eléctrica de más tres (+3). Los pequeños círculos rellenos de color verde corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del antimonio en estado fundamental es de más tres (+3).
Fig. No1.
ESTADO EXCITADO del ÁTOMO de ANTIMONIO
El único estado en excitación del antimonio con la carga eléctrica de más tres (+3), tiene a un par de electrones libres y tres (3) pares donde cada electrón está apareado con un hueco.
El átomo de antimonio en su estado excitado con la carga eléctrica de más 3, tiene según la nueva regla del octeto 3 electrones enlazantes por el hecho de tenerlos a cada uno de ellos apareados con un hueco.
Los pares enlazantes son aquellos electrones aptos para los enlaces de un solo electrón y además, los enlaces covalentes compartidos en donde cada átomo aporta en el enlace a un electrón y a un hueco.
Los pares de electrones libres, no son pares enlazantes pero, son los electrones aptos para configurar a los enlaces coordinados, los enlaces de tres electrones y los enlaces hipervalentes.
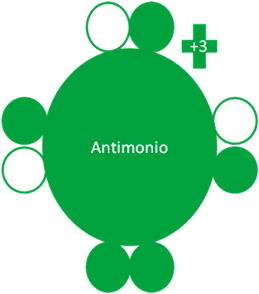
Átomo de Antimonio excitado con la carga eléctrica de más tres (+3). Los pequeños círculos rellenos de verde corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Antimonio es de más tres (+3).
Fig. No.2
HIPERVALENCIA a PARTIR de un ANTIMONIO en estado EXCITADO
El antimonio en estado excitado con la carga eléctrica de más tres (+3) tiene, a tres electrones enlazantes que configurarían a tres enlaces covalentes compartidos que tienen dos electrones y dos huecos.
Con el par de electrones libres del antimonio excitado, configuraría a dos (2) enlaces hipervalentes donde cada uno tendría a dos electrones y a un solo hueco.
Es decir que el antimonio excitado delante de un ligando como flúor, tiene todas las herramientas para configurar el pentafluoruro de antimonio de geometría bipiramidal trigonal, donde se configuraría 3 enlaces cortos, ecuatoriales, covalentes compartidos, de dos electrones y dos huecos, además configurarían a dos enlaces largos, hipervalentes y axiales.
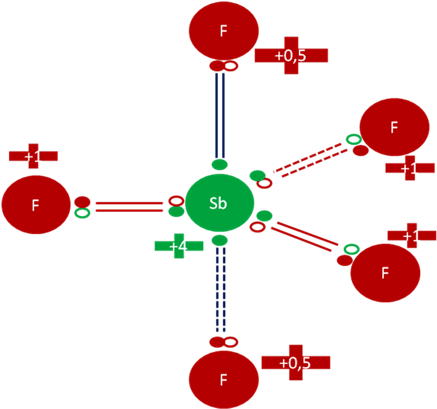
Pentafluoruro de Antimonio tipo geometría bipiramidal trigonal. Los dos pares de barras de color azul oscuro representan a los dos enlaces largos, axiales e hipervalentes. Los 3 pares de barras de color rojo representan a los 3 enlaces cortos, covalentes compartidos de dos electrones y de dos huecos y de disposiciones ecuatoriales. Los pequeños círculos rellenos de verde y rojo corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Antimonio es de más cuatro (+4). La carga eléctrica de los átomos axiales de flúor es de más punto cinco (+0,5). La carga eléctrica de los átomos ecuatoriales de flúor es de más uno (+1).
Fig. No.3.
Nótese en la figura anterior, que la carga eléctrica de los átomos de flúor no es la misma, hay unos como los axiales que tienen carga eléctrica de más punto cinco (+0,5), mientras los átomos ecuatoriales de flúor tienen carga eléctrica de más uno (+1).
Nótese también que la carga eléctrica del antimonio, en la reacción pasa de más tres (+3) a más cuatro (+4).
HIPERVALENCIA a PARTIR del ANTIMONIO en estado FUNDAMENTAL
El antimonio en estado fundamental tiene a un solo electrón enlazante porque es el único que está apareado con un hueco.
Ese único electrón que está apareado con un hueco, es el único electrón capaz de configurar un enlace que sea covalente compartido corto con dos electrones y dos huecos.
En el antimonio fundamental hay dos pares de electrones libres, que son 4 electrones capaces de configurar a 4 enlaces hipervalentes.
En el antimonio fundamental queda un par de huecos que son aptos para configurar un enlace covalente coordinado actuando el antimonio como un átomo aceptor de electrones.
Entonces con los 4 enlaces hipervalentes y un enlace covalente compartido que conste de dos electrones y dos huecos, queda configurado otra molécula de pentafluoruro de antimonio que sería un isómero porque la forma de la molécula sería distinta. Se formaría así un pentafluoruro de antimonio de geometría piramidal cuadrada que tendría a un par de huecos libres.
PENTAFLUORURO de ANTIMONIO con GEOMETRIA PIRAMIDAL CUADRADA
En la siguiente figura se observa que la carga eléctrica del antimonio pasa de más tres (+3) en el estado fundamental, a más cinco (+5) en el isómero.
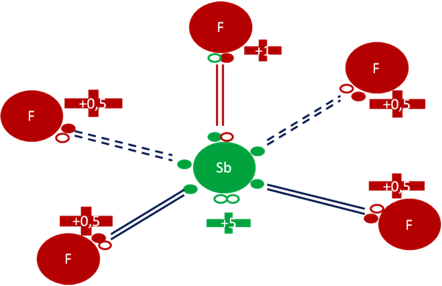
Pentafluoruro de Antimonio isómero geometría Piramidal Cuadrada. El par de barras de color rojo representan al único enlace covalente compartido, corto, central, compuesto por dos electrones y dos huecos. Los 4 pares de barras de color azul oscuro representan a los 4 enlaces largos e hipervalentes de disposiciones basales. Los pequeños círculos rellenos de verde y rojo corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Antimonio es de más cinco (+5). La carga eléctrica del átomo central de flúor es de más uno (+1). La carga eléctrica de los cuatro átomos basales de flúor es de más punto cinco (+0,5).
Fig. No.4.
En la figura anterior nótese que al átomo de antimonio le quedan un par de huecos libres, quienes más tarde configuraran un enlace de coordinación.
Al átomo de flúor ubicado en la parte central de la molécula, es el único flúor que queda con la carga eléctrica original de más uno (+1).
Los cuatro átomos hipervalentes de flúor adquieren una carga eléctrica de más punto cinco (+0,5).
FLUORURO de HIDRÓGENO
El fluoruro de hidrógeno es la molécula diatómica de un átomo de flúor enlazado en enlace covalente compartido con un átomo de hidrógeno.
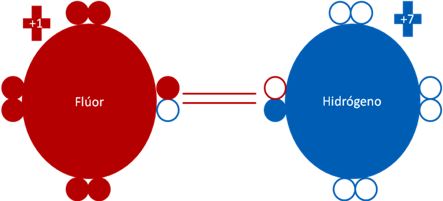
Fluoruro de Hidrógeno. El par de barras horizontales y centrales de color rojo representan al único enlace covalente compartido que consta de dos electrones y dos huecos. Los pequeños círculos de colores azules y rojos representan a los electrones del átomo que tiene el mismo color. Los pequeños círculos vacíos corresponden a los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del flúor es de más uno (+1). La carga eléctrica del hidrógenos de más siete (+7).
Figura No.5.
Nótese que la carga eléctrica del flúor y el hidrógeno, es la misma carga eléctrica original de más uno (+1) y más siete (+7).
IÓN FLUORURO (F-1) e IÓN HIDROGENIÓN (H+9).
Cuando el fluoruro de hidrógeno se introduce o se disuelve en una disolución acuosa, aparece disociación en alguna medida y se convierte en ión fluoruro (F-1) y el ión hidrogenión (H+9).
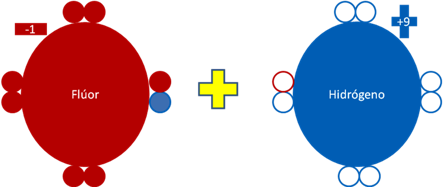
El ión fluoruro, que es un flúor sin huecos como partícula en la valencia y con una carga eléctrica de menos uno (-1). Más un átomo de hidrógeno también ionizado pero sin electrones y con una carga eléctrica de más nueve (+9). Los círculos rellenos de rojo y azul corresponden a los electrones del átomo que tiene su mismo color. Los círculos vacíos corresponden a los huecos del átomo que tiene su mismo color de línea. El signo más de color amarillo representa a la mezcla.
Figura No.6.
En la figura anterior nótese que la carga eléctrica del ión fluoruro (F-1), es de menos uno (-1) y queda totalmente libre de huecos como partículas de valencia.
Nótese también en esta misma anterior figura, el ión fluoruro está desligado del ión hidrogenión, que queda con una carga eléctrica de más nueve (+9) y está totalmente libre de electrones.
MEZCLA de FLUORURO de HIDROGENO más PENTAFLUORURO de ANTIMONIO PIRAMIDAL
Mezclando el ácido fluorhídrico (HF) y el isómero pentafluoruro de antimonio (SbF5) de geometría piramidal cuadrada, se obtiene así al anión [Sb2F11]-1 que tiene interno al anión fluoruro (F-1), más el catión hidrogenión (H+9) que lo secuestra una molécula de HF.
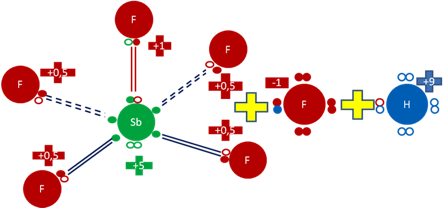
Pentafluoruro de Antimonio tipo geometría Piramidal Cuadrada más el anión fluoruro (F-1) más el ión hidrogenión (H+9). El par de barras de color rojo representan al único enlace covalente, corto, central, compuesto por dos electrones y dos huecos. Los 4 pares de barras de color azul oscuro representan a los 4 enlaces largos e hipervalentes de disposiciones basales. Los pequeños círculos rellenos de verde, azul y rojo corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del Antimonio es de más cinco (+5). La carga eléctrica del átomo de flúor central es de más uno (+1). La carga eléctrica de los cuatro átomos de flúor basales es de más punto cinco (0,5). La carga eléctrica del ión fluoruro es de menos uno (-1). La carga eléctrica del hidrogenión es de más nueve (+9). El pequeño círculo vacío de color de línea roja en el ión hidrogenión representa al octavo hueco del hidrógeno que procede del flúor. Los signos más de color amarillo representan la mezcla.
Fig. No.7.
CATIÓN de HEXAFLORURO de ANTIMONIO SbF6-1.
Este pentafluoruro de antimonio que tiene geometría piramidal cuadrada en la anterior figura, tiene un par de huecos libres, que son quienes le entregan al pentafluoruro las propiedades para ser un ácido de Lewis. En este par de huecos libres son los que reaccionan con el sexto flúor a través de un enlace de coordinación donde el antimonio juega un papel de aceptor de electrones. La carga eléctrica del antimonio se altera de más cinco (+5) se convierte en más tres (+3) porque tiene un electrón adicional.
Catión Hexafluoruro de Antimonio. Los dos pares de barras de color rojo representan a los dos enlaces covalentes compartidos, cortos, axiales, compuestos cada uno por dos electrones y dos huecos. Los 4 pares de barras de color azul oscuro representan a los 4 enlaces largos e hipervalentes de disposiciones ecuatoriales. Los pequeños círculos rellenos de verde, azul y rojo corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. El pequeño círculo de color azul representa al electrón que le quitó al hidrógeno el flúor dador. La carga eléctrica del Antimonio es de más tres (+1). La carga eléctrica de los átomos axiales de flúor es también de más uno (+1). La carga eléctrica de los átomos ecuatoriales de flúor es de más punto cinco (+0,5).
Fig. No8.
DOS MOLÉCULAS de PENTAFLUORUROS PIRAMIDALES SECUESTRAN a un ANIÓN FLUORURO
El ácido fluoroantimónico es una mezcla de Fluoruro de hidrógeno (HF) con el Pentafluoruro de Antimonio Piramidal en distintas proporciones.
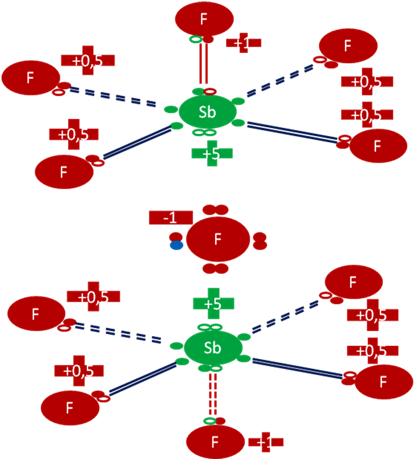
En la figura hay dos moléculas de Pentafluoruro antimónico piramidal y además en el centro de ellos hay un ión fluoruro. El par de barras de color rojo en cada pentafluorurro representan al único enlace covalente, corto, central y compuestos cada uno por dos electrones y dos huecos. Los 4 pares de barras de color azul oscuro representan a los 4 enlaces largos e hipervalentes de disposiciones basales. Los pequeños círculos rellenos de verde, azul y rojo corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. La carga eléctrica de los Antimonios es de más cinco (+5). La carga eléctrica de los átomos de los átomos de flúor centrales es de más uno (+1). La carga eléctrica del ión hidrogenión es de más nueve (+9). El pequeño círculo relleno de color azul representa al octavo electrón del ión fluoruro que procede del hidrógeno.
Fig. No.9.
ESTRUCTURA del ÁCIDO FLUOROANTIMÓNICO
En la estructura del ácido fluoroantimónico no podemos dejar de referirnos a la estructura molecular del anión [Sb2F11]-1 y el catión [H2F]+1.
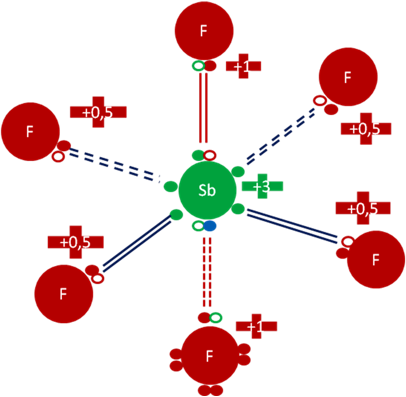
ANIÓN [Sb2F11]-1.
El anión [Sb2F11]-1se forma por la unión química del anión fluoruro, a través de dos enlaces coordinados, con los dos antimonios de dos moléculas de pentafluoruros piramidales distintas.
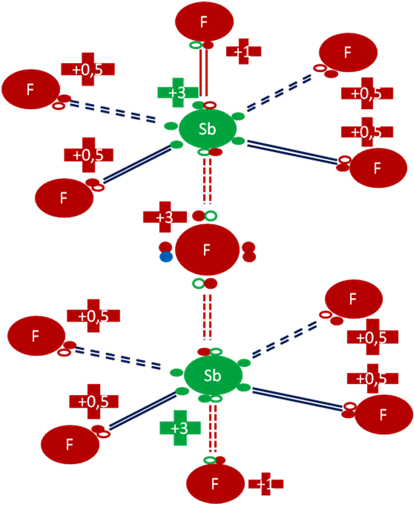
Anión [Sb2F11]-1 que tiene once (11) átomos de flúor y dos (2) átomos de antimonio. El átomo de flúor que sirve de puente a través de dos enlaces covalentes compartidos entre los dos pentafluoruros tiene una carga eléctrica de más tres (+3). Los ocho (8) átomos hipervalentes de flúor de posiciones ecuatoriales en cada antimonio tienen una carga eléctrica de más punto cinco (+0,5). Los dos átomos de flúor ubicados en los extremos del anión tienen una carga eléctrica de más uno (+1). Los dos átomos de antimonio tienen carga eléctrica de más tres (+3).
Figura No.10.
La proporción 1:1 del pentafluoruro de antimonio piramidal y el fluoruro de hidrógeno, produce la formación del superácido más fuerte visto que protona inclusive a los hidrocarburos, para producir carbocationes e hidrógeno.
La reacción de fluoruro de hidrógeno (HF) y del pentafluoruro de antimonio piramidal es exotérmica.
El fluoruro de hidrógeno libera al catión hidrogenión (H+9) con carga eléctrica de más nueve (+9) y también libera al anión fluoruro (F-1) que tiene carga eléctrica de menos uno (-1).
El catión hidrogenión que se libera, es el mismo hidrógeno pero sin electrones y con una valencia de 4 pares de huecos.
Dentro de los 4 pares de huecos de valencia del catión hidrogenión, hay un hueco que procede del flúor, hueco que le quedó del intercambio que realizó con el flúor entregando al único electrón que tenía el hidrógeno quien recibe a un hueco de recompensa para no violar la nueva regla del octeto.
El anión fluoruro (F-1) que libera el fluoruro de hidrógeno (HF), es un anión que tiene a 4 pares de electrones de valencia y no tiene huecos, le ocurre lo inverso de lo que le ha pasado al hidrogenión. Es decir el anión fluoruro tiene una configuración de valencia semejante a un gas noble, con 8 electrones de valencia pero está cargado eléctricamente con -1 porque posee un electrón adicional.
Ese electrón adicional que tiene el anión fluoruro, viene procedente del hidrógeno, lo posee el flúor porque lo negoció con el hueco que tenía apareado con su único electrón enlazante, ya que los demás electrones del ión fluoruro son pares libres de electrones no enlazantes aptos para enlaces de coordinación o enlaces hipervalentes.
El anión fluoruro (F-1) que libera el fluoruro de hidrógeno (HF), es suficiente para reaccionar con una molécula de Pentafluoruro de Antimonio Piramidal.
Las propiedades y condiciones de ese anión fluoruro debido a su estructura de valencia, es configurar un enlace de coordinación y precisamente, ese es el enlace que efectúa con el par de huecos libres que tiene el estado fundamental del antimonio en el pentafluoruro de antimonio piramidal.
Esa reacción química entre el anión fluoruro (F-1) con el pentafluoruro de antimonio piramidal, produce al anión (SbF6-1) hexafluoruro de antimonio Octaédrico.
En esta mezcla entre el pentafluoruro de antimonio piramidal y fluoruro de hidrógeno, el catión hidrogenión (H+9) permanece efectivamente “desnudo”, cuestión que trae como consecuencia la extrema acidez de la mezcla.
El ácido fluoroantimónico es 2x1019 más fuerte que el ácido sulfúrico.
El ácido fluoroantimónico es más fuerte que el ácido mágico.
El ácido fluoroantimónico es más fuerte que el superácido carborano.
El ácido fluoroantimónico es más fuerte que el ácido fluorosulfúrico.
El ácido fluoroantimónico es más fuerte incluso que el ácido tríflico.
CATIÓN [H2F]+1.
El catión [H2F]+1 se forma por la unión de un ión hidrogenión, con una molécula de fluoruro de hidrógeno.
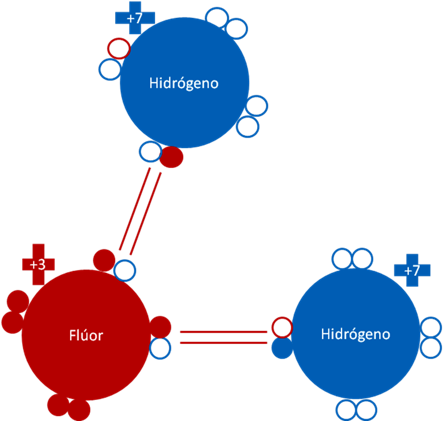
Catión [H2F]+1 que acompaña al anión [Sb2F11]-1 en la mezcla del ácido fluoroantimónico. Los dos pares de barras de color rojo representan a dos enlaces covalentes compartidos y uno de ellos es un enlace de coordinación. Los pequeños círculos rellenos de colores azul y rojo representan a los electrones del átomo que tiene su mismo color. Los pequeños círculos vacíos corresponden a los huecos del átomo que tiene su mismo color de línea. La carga eléctrica del flúor es de más tres (+3). La carga eléctrica de los dos hidrógenos es de más siete (+7).
Figura No.11.
CATIÓN [H3F2]+1.
El catión [H3F2]+1 se forma por la unión de dos moléculas de fluoruro de hidrógeno, rodeando a un hidrogenión.
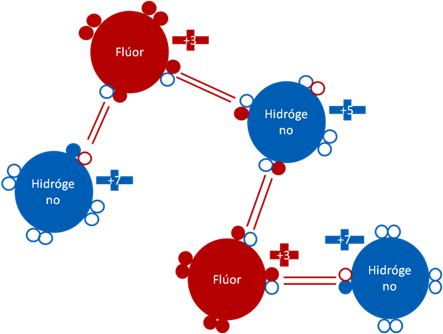
Catión [H3F2]+1 que acompaña al anión [Sb2F11]-1 en la mezcla del ácido fluoroantimónico. Los 4 pares de barras de color rojo representan a 4 enlaces covalentes compartidos pero los dos enlaces del hidrógeno secuestrado son enlaces de coordinación. El hidrógeno secuestrado tiene una carga eléctrica de más cinco (+5). Los pequeños círculos rellenos de colores azul y rojo representan a los electrones del átomo que tiene su mismo color. Los pequeños círculos vacíos corresponden a los huecos del átomo que tiene su mismo color de línea. La carga eléctrica de los átomos de flúor es de más tres (+3). La carga eléctrica de los hidrógenos no secuestrado es de más siete (+7).
Figura No.12.
3- Conclusiones:
a)- PRIMERA CONCLUSIÓN es que los enlaces de uno y tres electrones, los enlaces hipervalentes y los enlaces iónicos, todos ellos modifican la carga eléctrica de los átomos que intervienen en los respectivos enlaces.
b)- SEUNDA CONCLUSIÓN es que el único enlace químico que respeta a la carga eléctrica original del átomo es el enlace covalente compartido, enlace donde intervienen dos electrones y dos huecos como partículas.
c)- TERCERA CONCLUSIÓN es que la nueva regla del octeto a través de los llamados huecos como partículas, explican el mecanismo del efecto túnel en mecánica cuántica.
d)- CUARTA CONCLUSIÓN es la estructura molecular del [Sb2F11]-1 que tendría la forma transversal que tiene el tren de rodamiento de cualquier vehículo, donde el perfil de las dos ruedas o llantas serían los dos círculos de los cuatro fluoruros con cargas eléctricas de más punto cinco (0,5), que girarían alrededor de los centros de antimonio unidos en el centro por el eje fluoruro céntrico de carga eléctrica de más tres (+3). A lado y lado de cada extremo de las ruedas o llantas continuaría en las puntas del eje central se ubicarían los dos fluoruros laterales que tienen cargas eléctricas de más uno (+1).
e)- QUINTA CONCLUSIÓN es con respecto a la carga eléctrica del silicio y el fósforo en los dopaje tipo N. el silicio tiene carga eléctrica original de +4 y el fósforo tiene carga eléctrica original de +3 pero, en el dopaje tipo N de silicio con fósforo, este ultimo a través de un enlace de 3 electrones le transfiere un electrón a uno de los 4 silicios vecinos y él, convierte su carga de +3 a +4 y el silicio, inversamente la convierte de +4 a +3.
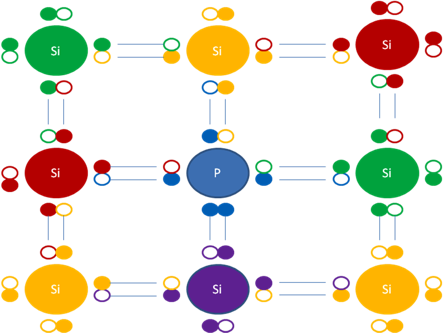
Si, representa al átomo de silicio, P, representa al átomo de fósforo. Esta figura representa un enlace de 3 electrones. Los pequeños círculos rellenos de colores representan a los electrones que pertenecen al átomo de su mismo color. Los pequeños círculos vacíos representan a los huecos como partículas que pertenecen al átomo de su mismo color de línea.
Figura No.13.
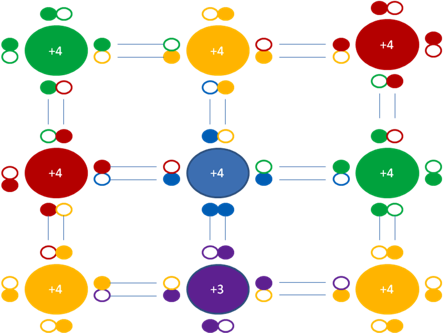
+4 en el átomo central de color azul representa a la carga eléctrica adquirida por el fósforo quien cede un electrón al silicio inferior vecino de color fucsia que tiene carga eléctrica adquirida de +3. Los pequeños círculos rellenos de colores representan a los electrones que pertenecen al átomo de su mismo color. Los pequeños círculos vacíos representan a los huecos como partículas que pertenecen al átomo de su mismo color de línea.
Figura No.14.
Igual sucede en los dopajes tipo P en el mismo silicio con el boro, quien tiene una carga eléctrica original de +5. En los dopajes tipo el átomo dopante del boro toma un electrón de uno de los átomos vecinos de silicio, convirtiendo su carga eléctrica original de +5 a +4, el átomo de silicio que le cede el electrón inversamente convierte su carga eléctrica de +4 a +5.
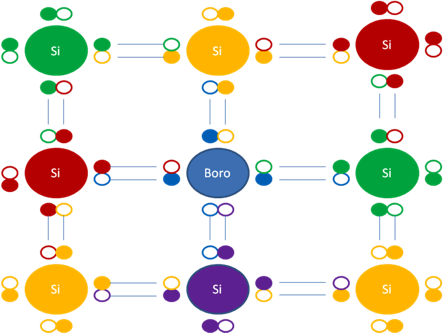
Si, representa al átomo de silicio, En el centro se encuentra el átomo de Boro. Esta figura representa un enlace de un electrón. Los pequeños círculos rellenos de colores representan a los electrones que pertenecen al átomo de su mismo color. Los pequeños círculos vacíos representan a los huecos como partículas que pertenecen al átomo de su mismo color de línea.
Figura No.15.
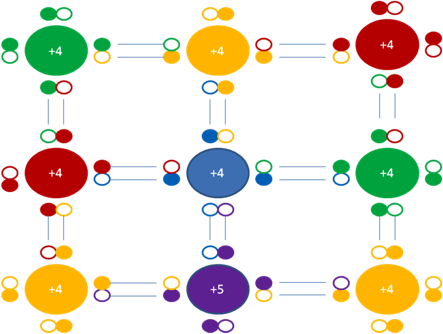
+4 en el átomo central de color azul representa a la carga eléctrica adquirida por el Boro quien recibe un electrón del silicio inferior vecino de color fucsia que tiene carga eléctrica adquirida de +5. Los pequeños círculos rellenos de colores representan a los electrones que pertenecen al átomo de su mismo color. Los pequeños círculos vacíos representan a los huecos como partículas que pertenecen al átomo de su mismo color de línea.
Figura No.16.
Al unir ambos cristales definidos en las anteriores figuras 13 a 16, aparece la denominada BARRERA INTERNA DE POTENCIAL, o ZONA DE CARGA ESPACIAL, o ZONA DE AGOTAMIENTO, o ZONA DE EMPOBRECIMIENTO, o ZONA DE VACIADO o DEPLECIÓN que va aumentado su anchura a medida que transcurre la difusión a ambos lados de la unión, acumulándose del lado N átomos de silicio con carga eléctrica de +3, aunque del lado P también se acumulan átomos de silicio pero con carga eléctrica de +5. Esto crea un campo eléctrico entre los átomos de silicio distintamente cargados en la unión. DE UN LADO HAY ÁTOMOS DE SILICIO CON CARGA ELÉCTRICA DE +3 Y DEL OTRO LADO ESTÁN UBICADOS ÁTOMOS DE SILICIO CON CARGA ELÉCTRICA DE +5. La anchura de la ZONA DE CARGA ESPACIAL una vez alcanzado el equilibrio, depende de si es un cristal de silicio, germanio u otro elemento y de la intensidad del dopaje.
4- Referencias
REFERENCIAS DEL ARTÍCULO.
[1] Dióxido de cloro
[2] Dióxido de cloro
[3] Pentafluoruro de Antimonio
[4] Pentafluoruro de Antimonio
[5] Tetróxido de Osmio
[6] Enlaces Hipervalentes
[7] Enlaces en moléculas Hipervalentes
[8] Nueva regla del octeto
[9] Estado fundamental del átomo
[10]Estado fundamental del átomo
[11]Barrera rotacional del etano.
[12]Enlaces de uno y tres electrones.
[13]Enlaces de uno y tres electrones.
[14]Origen de la barrera rotacional del etano
[15]Monóxido de Carbono
[16]Nueva regla fisicoquímica del octeto
[17]Células fotoeléctricas Monografías.
[18]Células Fotoeléctricas textoscientificos.
[19]Semiconductores Monografías.
[20]Semiconductores textoscientificos.
[21]Superconductividad.
[22]Superconductividad.
[23]Alotropía.
[24]Alotropía del Carbono.
[25]Alotropía del Oxigeno.
[26]Ozono.
[27]Diborano
[28]Semiconductores y temperatura.
REFERENCIAS DE LA TEORÍA
[1] Número cuántico magnético.
[2] Ángulo cuántico
[3] Paul Dirac y Nosotros
[4] Numero cuántico Azimutal monografias
[5] Numero cuántico Azimutal textoscientificos
[6] Inflación Cuántica textos científicos.
[7] Números cuánticos textoscientíficos.com.
[8] Inflación Cuántica Monografías
[9] Orbital Atómico
[10] Números Cuánticos.
[11] Átomo de Bohr.
[12] Líneas de Balmer.
[13] Constante Rydberg.
[14] Dilatación gravitacional del tiempo.
[15] Número Cuántico magnético.
[16] Numero Cuántico Azimutal.
Copyright © Derechos Reservados.
Heber Gabriel Pico Jiménez MD. Médico Cirujano 1985 de la Universidad de Cartagena Colombia. Investigador independiente de problemas biofísicos médicos propios de la memoria, el aprendizaje y otros entre ellos la enfermedad de Alzheimer.
Estos trabajos, que lo más probable es que estén desfasados por la poderosa magia secreta que tiene la ignorancia y la ingenuidad, sin embargo, como cualquier representante de la comunidad académica que soy, también han sido debidamente presentados sobretodo este se presentó el 06 de Octubre del 2013 en la “Academia Colombiana de Ciencias Exactas, Físicas y Naturales” ACCEFYN.