Existen dos formas principales, por la cual son formados los radicales libres para comenzar una polimerización: por escisión hemolítica de en enlace simple o por transferencia de electrones desde un ion o una molécula. La hemólisis de un enlace simple es normalmente lograda por acción del calor, existiendo muchos compuestos que sufren termólisis en un rango de temperaturas de 50-100ºC. Los iniciadores que sufren termólisis más comúnmente utilizados son los persulfatos. Como puede verse en las ilustraciones, la única diferencia entre los distintos iniciadores del tipo persulfato, es el contraión. Sin embargo, la diferencia en el contraión trae aparejada una fuerte diferencia en el peso molecular, lo cual indica que los iniciadores no pueden ser intercambiados utilizando la misma masa. Una segunda diferencia importante entre los distintos persulfatos es su solubilidad, como puede verse en las tablas adjuntas, si comparamos los persulfatos de amonio, sodio y potasio. El persulfato de potasio necesita más agua para lograr su disolución resultando, por lo tanto, en que sólo bajas concentraciones de iniciador podrán ser preparadas. Una tercera razón, por la cuál los iniciadores no pueden intercambiarse fácilmente es la diferencia entre los tiempos de vida media de los diferentes persulfatos, que se verá en una tabla posterior.
Iniciadores solubles en agua
| Iniciación por descomposición térmica: | peso molecular |
solubilidad (g/l H2O, 20°C) |
|---|---|---|
| amonio peroxodisulfato (APS):(NH4)2S2O8 | 228.2 | 620 g/l |
| sodio peroxodisulfato (NaPS):Na2S2O8 | 238.1 | 545 g/l |
| Potasio peroxodisulfato (KPS):K2S2O8 | 270.3 | 50 g/l |
| Peroxido de Hidrógeno:H2O2 | 34.02 | miscible |
Iniciadores de peroxodisulfato
Muestran esencialmente dos mecanismos de descomposición pH-dependientes. En contacto con el agua se descomponen en sulfato y en fragmento de peroxosulfato.
Condiciones ácidas
El fragmento de peroxosulfato es inestable en un medio ácido y por lo tanto se descompone rápidamente en peróxido de hidrógeno y en un fragmento de sulfato.
Condiciones básicas
El fragmento de peroxosulfato es más estable en un medio básico. Se descompone bajo esfuerzo térmico.
Peróxido de Hidrógeno como iniciador
Se descompone a 80°C. Sin embargo, pequeñas impurezas tales como los restos metálicos y las sales alcalinas catalizan fuertemente la descomposición. La catálisis alcalina es demasiado eficaz para permitir el uso del peróxido de hidrógeno como iniciador en un medio alcalino, la reacción puede quedar fuera de control.
Iniciadores
Los iniciadores de peróxido comunes (por lo común compuestos de azufre con un alto grado de oxidación) pueden combinarse con agentes reductores de manera de comenzar la polimerización ya a bajas temperaturas. Como agregado se puede introducir un catalizador para aumentar la relación de la formación radical.
Agentes de reducción
Por lo general se utilizan compuestos de azufre con un bajo grado de oxidación como agentes reductores.
El disulfito o el metabisulfito de sodio (el cual se hidrata en bisulfito de sodio en agua), el tiosulfato de sodio, sulfito de sodio o sulfooxalato de formaldeído (Rongalit) sirven como dadores de electrones en la reacción Redox.
Catalizadores
Las sales de hierro (II) se utilizan comúnmente como catalizadores, especialmente el sulfato de hierro (II) y las “sales de Mohr” (Iron (II) ammonium sulfate hexahydrate).
Estas sales se agregan en cantidades catalíticas algo bajas a fin de aumentar el grado de descomposición del sistema Redox. Debido a que el ion de hierro (II) primero se oxida y luego en una segunda etapa se reduce nuevamente, su actividad se regenerará a través de la reacción y en consecuencia no se agotará.
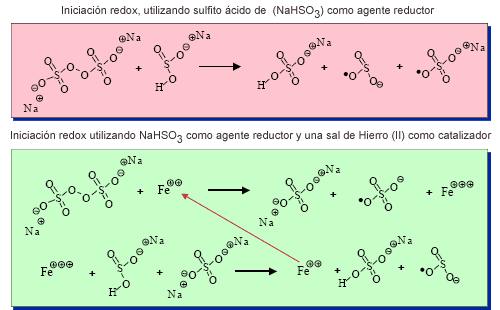
Los mecanismos de descomposición del iniciador acrecentado por Redox, con y sin catalizador, se muestran en el siguiente cuadro.
Iniciadores solubles en agua - Iniciación redox
Tal como se ilustra en la sección superior del gráfico, la presencia de un agente reductor lleva a una descomposición más rápida y eficaz de la molécula del iniciador. En lo esencial, un mecanismo similar vale para la descomposición del iniciador acrecentado por Redox, con la diferencia que cantidades catalíticas de hierro (II) hacen el papel de agente reductor, el cual primero es oxidado por el iniciador y luego reducido nuevamente por el agente bisulfito, acrecentando de este modo el grado de reacción aún más que con el simple uso del sistema Redox. Estos mecanismos de arranque que implican el uso de sistemas Redox y Redox catalizados permiten comenzar la polimerización a temperaturas tan bajas como los 20°C. De todos modos, a temperaturas tan bajas es difícil controlar la reacción en lo que hace a la disipación del calor.
Proceso de iniciación y propagación en cadena
La reacción inicial en la polimerización radical está determinada por dos etapas: descomposición del iniciador y adición radical al primer monómero. La velocidad de reacción depende del grado de descomposición (por ej. la mitad del tiempo de vida, la energía de activación) del iniciador, el cual a su vez depende de la temperatura. El radical que resulta de la descomposición del iniciador es una especie altamente reactiva que reacciona con facilidad con la unión doble de una primera molécula de monómero al formar una unión covalente y otro radical en el lugar terminal del monómero.
Este radical terminal es ahora capaz de agregar otra unidad de monómero no saturada, lo cual conduce al crecimiento de la cadena polimérica. La reacción del crecimiento requiere una activación mucho más baja de la energía comparada con la reacción de iniciación, por lo tanto su velocidad es menos dependiente de la temperatura que la velocidad bruta de reacción de la reacción inicial.