Ley de Boyle-Mariotte
“A temperatura constante, los volúmenes de una masa gaseosa son inversamente proporcionales a las presiones que soporta”
![]()
[2.17]
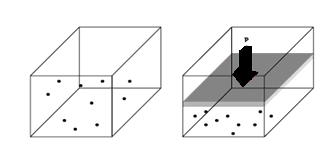
esquema de la ley de boyle para un gas
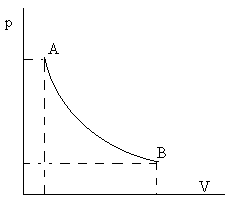
Isoterma. Gráfico PV
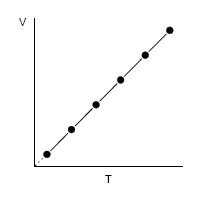
Ley de Charles y Gay-Lussac
“a presión constante, los volúmenes de una masa de gas son directamente proporcionales a las respectivas temperaturas absolutas”
Gay-Lussac obtuvo experimentalmente:
![]()
o bien
![]()
[2.18]
Ley de Avogadro
“Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas"
La cantidad de material se describe en función del número de moles. Esta unidad de materia se corresponde a un número de partículas dado por la constante de Avogadro
N = 6.022 x 1023 mol-1 [2.19]
Simbólicamente la Ley de Avogadro se describe como:
V ∝ n [2.20]
De acuerdo con la Ley de Avogadro, el volumen ocupado por un mol de cualquier gas es el mismo a una temperatura y presión fijas. Cuando T = 0°C y P = 1 atm, este volumen es de 22.4 L. Las condiciones antes mencionadas, T = 0°C y P = 1 atm, se denominan condiciones estándar, y se representa como PTE (presión y temperatura estándar).
El volumen de 1 mol de gas se representa como el volumen molar (Vm). Por lo tanto, la Ley de Avogadro se representa por la siguiente igualdad:
Vm = 22.4 lts a PTE [2.21]
Si denominamos n al número de moles de un cierto gas, entonces el volumen ocupado por esta cantidad será:
V = n.Vm [2.22]
Al igual que con las otras leyes, la Ley de Avogadro sólo se cumple para un gas poco denso.
Conclusión
Las observaciones anteriores generalizan un comportamiento para los gases poco densos. Estos gases poco densos y que cumplen con las leyes de Boyle, Charles y Avogadro se denominan gases perfectos.
Combinando las conclusiones de las leyes que describen al gas perfecto:
V∝ 1/P o PV = CTE Ley de Boyle
V ∝ T Ley de Charles
V ∝ n Ley de Avogadro
se puede concluir que
PV ∝ nT [2.23]
Para poner esta expresión como una igualdad, es necesario definir una constante de proporcionalidad, que llamaremos constante molar del gas perfecto o, como se la conoce usualmente, constante de los gases, simbolizada por R. El valor de R es independiente de la naturaleza del gas, y vale 0.082 L atm mol-1 K-1.
Con esta definición, llegamos a una ecuación que describe el comportamiento del gas perfecto:
PV = nRT [2.24]
Obsérvese que la expresión [2.24] es equivalente a la [2.16]