Gases
Los gases se dividen, de acuerdo a sus propiedades termodinamicas en 2 grandes grupos:
- Perfectos o ideales
- Imperfectos o reales
La propiedad fundamental de un gas perfecto es que puede admitir cualquier valor de los 3 parámetros térmicos (presion, volumen y temperatura) sin cambiar de fase.
Un gas perfecto es puramente ideal.
Gases ideales o perfectos
Cumplen con la Ley de Boyle-Mariotte y las de Charles-Gay Lussac, las cuales se resumen en una sola ley:
Ecuación de estado de los gases perfectos o ideales:
P * V = m * Rp * T
o
P * V = n * Ru * T
A bajas presiones y altas temperaturas, los gases tienden a comportarse como ideales o perfectos. Por ejemplo, el aire a 25ºC y 1 atm. de presión se comporta como un gas perfecto.
En cambio cuando las presiones son altas y las temperaturas son muy bajas, los gases tienden a alejarse del comportamiento indicado por la ecuación de estado
Gases reales o imperfectos
Sus características, parámetros y comportamientos difieren de los de un gas perfecto.
Se puede hacer una división entre los gases reales:
- gases permanentes: no se pueden condensar
- vapores o fluidos condensables: se pueden condensar por la sola variación de la presion a la temperatura que se encuentran
Eexperiencias de andrews
En 1869, andrews publico sus ensayos con co2, al comprimirlo manteniendo la temperatura constante.
Utilizó un cilindro de paredes resistentes dentro del cual habia un manometro y un termometro.
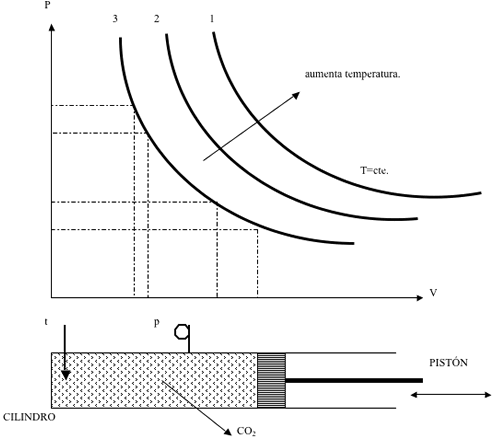
Para 1 temperatura determinada, andrews fue disminuyendo el volumen y leyendo la presion.
A medida que disminuia la temperatura, fue notando que la hiperbola equilatera se iba deformando
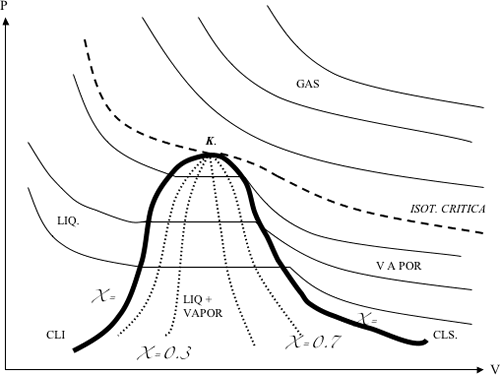
Dentro de la campana las isotermicas coinciden con las isobaricas, es decir que un cambio de fase , de liquido a vapor, se produce sin cambios en la presion ni la temperatura.
Cambios de estado o de fase
- fusion y solidificacion (liquidos y sólidos)
- evaporacion y condensacion ( liquidos y vapores)
- sublimacion (de sólido a vapor)
A medida que aumenta la temperatura, la forma de las isotermas se parece cada vez mas a una hiperbola equilatera, como seria si el gas se comportase como perfecto
De la experiencia andrews determinó lo sigiuente:
- punto critico
- curva limite superior
- curva limite inferior
- zona heterogenea
- Isoterma critica
Liquido saturado: es un liquido que se encuentra en equilibrio con su vapor. Es la cli, que separa la region liquida de la region liquido-vapor
Vapor saturado o vapor saturado seco: es un vapor que se encuentra en equilibrio con su liquido. Es la cls que separa la region vapor de la region liquido-vapor
Punto critico: es donde se unen las lineas de liquido saturado y de vapor saturado
Por ejemplo
para el CO2
temperatura critica: 31,35 ºc
Vapor humedo: es una mezcla de liquido y vapor saturado. Es la zona heterogenea debajo de la campana.
Titulo de un vapor = mv / mv + ml
En la cli, mv=0, por lo tanto x=0
En la cls, ml=0, por lo tanto x=1
Dentro de la campana habra curvas de titulo constante para x= 0,1 0,4 0,6 0,8 etc
Diagrama presión-temperatura de una sustancia
Las regiones bifásicas aparecen como lineas
Las regiones monofásicas se presentan como areas.
Las 3 lineas se juntan en el punto triple que es el punto donde coexisten los 3 estados de agregación
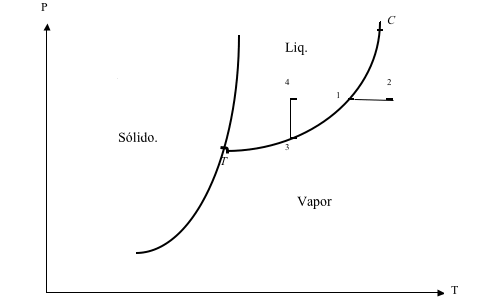
2------------ vapor sobrecalentado 4------------ liquido comprimido T------------ punto triple C------------ punto critico T-3-1-c:----- curva de saturación liquido-vapor o curva de vaporizacion
Gases reales
Ecuacion de van der waals
En 1873, Van der Waals obtuvo una ecuación que tenía en cuenta el apartamiento de los gases reales con relación a los gases perfectos o ideales.
La primera consideración fue en relación al volumen real ocupado por el gas.
Covolumen b: es el volumen propio de las moléculas de gas. Debe ser restado al volumen total ocupado por el gas.
En consecuencia la ecuación de estado quedaría de la siguiente manera:
P * (v-b) = Rp * T
La segunda consideración fue en relación a la presión.
Presión interna termodinámica: es una presión adicional a la determinada por un manómetro. Es debida a las fuerzas de atracción y repulsión entre las moléculas del gas
La presión total será entonces:
p + pi
Entonces la ecuación de estado será:
(p+pi)*(v-b) = Rp * T
La presión interna termodinámica será proporcional al cuadrado de la densidad de gas
pi = a. d2
d = densidad (kg/m3)
Como el volumen específico es la inversa de la densidad:
pi = a / v2
reemplazando será:
(p + a / v2 ) . (v-b) = Rp . T
Esta nueva ecuación de estado de Van der Waals tiene 3 constantes en lugar de una sola constante como tenía la ecuación de estado original.
Determinación de las 3 constantes de van der waals
Derivando la ecuación de Van der Waals en el punto crítico, en el cual la isoterma tiene un punto de inflexión a tangente horizontal, llegamos a:
b = vc / 3 a = 3 . pc . vc2 R = 8 . pc . vc 3 . Tc
Ley de estados correspondientes de van der waals
Si reemplazamos en la ecuación de Van der Waals los valores hallados de a, b y R dados anteriormente, tendremos
(p + 3 pc vc2) ( v - vc ) = 8 pc vc T v2 3 3 Tc
que si la dividimos por el producto pc * vc, la podemos escribir
( p + 3 ) ( v - 1 ) = 8 T pc (v/vc)2 vc 3 3 Tc
Van der Waals denominó parámetros reducidos a los cocientes entre los parámetros de un estado cualquiera y los correspondientes al estado crítico del gas, es decir:
pr = p ; Tr = T y vr = v pc Tc vc
Si introducimos los parámetros reducidos en la fórmula anterior, ésta nos quedará:
( pr + 3 ) * ( vr – 1 ) = 8 Tr vr2 3 3
Si esta ecuación fuera correcta se habría obtenido una ecuación de estado para todos los gases reales, que no contiene ninguna constante particular para un determinado gas, ya que las constantes que en ella aparecen son números independientes del gas considerado, de aquí Van der Waals dedujo la existencia de estados correspondientes y la denominada ley de estados correspondientes.
La ley de estados correspondientes de Van der Waals puede enunciarse del siguiente modo:
Gases diferentes en estados correspondientes se comportan de la misma manera, denominándose estados correspondientes a aquellos a los que le corresponden iguales parámetros reducidos.
Factor o coeficiente de compresibilidad
Un método de fácil aplicación para el tratamiento de gases reales es el del coeficiente de compresibilidad.
El científico Gou-Yen-Su propuso introducir el llamado coeficiente de compresibilidad. Dado que para los gases reales:
P * v ¹ R * T
Se puede restablecer la igualdad escribiendo:
P * v = Z * R * T 2-41
El coeficiente Z no es una constante, sino que es una función del estado del gas, es decir que:
Z = f ( p, T )
Si fuera simplemente así sería extremadamente laboriosa la utilización de este método, dado que habría que determinar para cada gas y para cada estado el valor correspondiente. Pero si se determinan en forma experimental valores de Z y se los grafica o tabula en función de los parámetros presión reducida y temperatura reducida, se observa que para gases diferentes los valores coinciden para iguales valores de dichos parámetros es decir, que en realidad:
Z = f ( pr , Tr )
En consecuencia se puede construir una única tabla o un único diagrama de coeficientes de compresibilidad válido para todos los gases. Este hecho implica que cuando dos gases diferentes están en estados tales que su presión reducida es igual y asimismo es igual su temperatura reducida, entonces se comportan de la misma manera y por lo tanto que existe una ley de estados correspondientes, que no es la de Van Der Waals ya que los volúmenes reducidos no van a coincidir.
Como un estado de un gas queda definido dados los parámetros p y T, o bien los parámetros p y v o finalmente los parámetros T y v deberá existir algún parámetro función del volumen que deberá coincidir para gases diferentes que se encuentran en estados correspondientes.
Vamos a tratar de determinar dicho parámetro. Para ello consideremos dos gases diferentes que se encuentran en estados correspondientes. Entonces deberá ser:
Z1 = Z2 [2-42]
Y además,
pr1 = pr 2 y Tr 1 = Tr 2
Por la [2-41], la [2-42] puede escribirse:
P1 v1 = P2 v2 [2-43] R1 T1 R2 T2
Pero se puede escribir:
P1 = pr1 pc1 T1 = Tr1 Tc1 P2 = pr2 pc2 T2 = Tr2 Tc2
Que reemplazadas en la [2-43] nos dan:
pr2 pc1 v1 = pr2 pc2 v2 R1 Tr1 Tc1 R2 Tr2 Tc2
Simplificando nos queda:
pc1 v1 = pc2 v2 R1 Tc1 R2 Tc2
Que la podemos escribir también:
v1 = v2 [2-44] R1 Tc1 R2 Tc2 pc1 pc2
En ambos denominadores tenemos el grupo:
R Tc = vsc pc
que tiene la dimensión de un volumen y lo denominamos seudo-crítico y que es el volumen que ocuparía el gas en el estado crítico si en él se comportara como perfecto.
Si denominamos volumen seudo-reducido al cociente entre el volumen del gas en un cierto estado y el volumen seudo-crítico del mismo
Vsr = V Vsc
Entonces la [2-44] nos da:
Vsr1 = Vsr2
Es decir que gases diferentes en estados correspondientes ocuparán volúmenes tales que sus volúmenes seudo-reducidos serán iguales.
Podemos en consecuencia decir que fases diferentes estarán en estados correspondientes cuando tengan iguales su presión reducida, su temperatura reducida y su volumen seudo-reducido.
Podrá entonces construirse un diagrama o tabla mediante el cual puede obtenerse el coeficiente de compresibilidad, para un estado de un gas real cualquiera cuando se conocen dos de los tres parámetros p, v y T.
Para el caso de mezclas de gases reales, un método que da resultados bastantes aceptables es el siguiente:
Se definen para la mezcla parámetros seudo-críticos:
psc = å xi pci
Tsc = å xi Tci
Y con ellos se determinan parámetros
P T v Psr = Psc ; Tsr = Tsc ; Psr = vssc
Y con estos parámetros seudo-reducidos se determina el coeficiente de compresibilidad de la mezcla.