Estado natural y obtención:
El azufre esta ampliamente distribuido en la naturaleza, como elemento, como H2S y SO2, en numerosos metales de sulfuros y sulfatos tales como la anhidrita (CaSO4), etc. Esta presente en el petróleo crudo, en el carbón y en el gas natural como H2S; de aquí se recupera en grandes cantidades según la reacción
2H2S + SO2 ![]() 3S + 2H2O
3S + 2H2O
En Luisiana y Texas en los Estados Unidos existen grandes depósitos de azufre a 300 metros de profundidad. Para su extracción se utiliza el método de Frasch que consiste en la inyección de agua sobrecalentada o vapor, teniendo en cuenta que el azufre funde a poco más que la temperatura de ebullición del agua pero menor al de el sobrecalentamiento de la misma. El azufre se funde y luego se lo extrae inyectando aire a presión. Luego el azufre es bombeado a silos de madera donde se solidifican en bloques, el azufre obtenido es de una pureza de hasta 99% por que las impurezas quedan en el yacimiento.
Variedades alotrópicas:
Azufre rómbico: Todas las modificaciones del azufre cristalino contienen
a) anillos de azufre, que pueden tener de 6 a 20 átomos de azufre, y se conocen como ciclohexa-, cicloocta-, etc. -azufre
b) cadenas de átomos de azufre conocidas como cadena-azufre (S∞).
1. Ciclooctaazufre (S 8). Esta es la forma más frecuente y tiene tres formas alotrópicas (en forma cristalina): Sα Sβ Sγ.
Azufre ortorrombico (Sα). Es la más estable de termodinámicamente, y se presenta en forma de grandes cristales amarillos en las áreas volcánicas. Se puede hacer crecer en soluciones, aunque los cristales contendrán parte del solvente. El Sα se convierte en su forma de alta temperatura, azufre monoclínico (Sβ). La entalpía de transición es baja (0.4 kj átomo-g¹- a 95.5°c) siendo el proceso lento; de tal manera que se puede alcanzar el punto de fusión del Sα (112.8°) por calentamiento rápido del Sα; el Sβ funde a 119°. El Sβ monoclínico cristaliza del azufre fundido, y a pesar de que hay una lenta conversión al Sα, se pueden conservar los cristales durante varias semanas.
Azufre monoclínico (Sγ, p.f. 106.8°) Se obtiene por descomposición del etil xenatato de cobre (I) en piridina. Se transforma lentamente en Sß y/o Sα, pero es estable en la región de 95-115°. Contiene anillas de S8 de corona.
2. Ciclohexaazufre (S6). Es azufre romboédrico (Sρ) que se obtiene por la siguiente reacción en éter.
S2Cl + H2S4 ![]() S6 + 2HCl
S6 + 2HCl
o por adición de Hcl concentrado a una solución de Na2S2O3 a -10°. Se descompone con bastante rapidez y, químicamente, es mucho mas reactivo que el S8 debido a que el anillo esta más tensionado; las reacciones se pueden ver profundamente afectadas por las impurezas y la luz.
Azufre líquido. No se sabe que ocurre cuando se funde el S8, aunque es indudable que depende mucho del nivel de impurezas.
Al fundirse el S8, primero se genera un líquido móvil, transparente y de color amarillo, que cambia a café, aumentando cada vez más su viscosidad alrededor de 160°. La viscosidad llega a su máximo aproximadamente a los 200°, a partir de allí disminuye hasta su punto de ebullición, 444.60°, el azufre vuelve a ser un liquido rojo oscuro, muy móvil.
Vapor de azufre. El vapor de azufre contiene, además del S8, S3, S4, S5, S7 y probablemente otras especies Sn en un equilibrio que depende de la temperatura. A altas temperaturas predominan las moléculas de S2; por encima de los 2200° y a presiones por debajo de 10-7, predominan los átomos de azufre. La especie S2 se puede enfriar rápidamente en nitrógeno liquido para dar un solidó de intenso color, inestable por encima de -80° y que contiene moléculas de S2. Estas moléculas tienen dos electrones no apareados.
Sulfuro de Hidrogeno:
Es el compuesto químicamente mas sencillo del azufre es uno de los compuestos de putrefacción de materiales como las huevos y cebollas, que contienen proteínas sulfuradas. Se puede obtener haciendo burbujear Hidrogeno en Azufre fundido pero es conveniente hacer reaccionar Sulfuro ferroso en un ácido diluido:
FeS + 2H+ ![]() Fe²+ +H2S
Fe²+ +H2S
Propiedades: Es soluble en agua, es venenoso y posee olor desagradable.
El sulfuro de Hidrogeno arde en el aire, con una llama azul, formando Dióxido de azufre:
2H2S + 3O2 ![]() 2H2O + 2SO2
2H2O + 2SO2
2H2S + SO2 ![]() 2H2O + 3S
2H2O + 3S
El sulfuro de hidrogeno es reductor lo que se demuestra en las dos reacciones anteriores donde el numero de oxidación del azufre aumenta de -2 a 4 en la primera y de -2 a 0 en la segunda.
La solución acuosa del sulfuro de hidrogeno es débilmente ácida. El sulfuro de hidrogeno se disuelve en agua formando ácido sulfhídrico, un ácido muy débil ionizado menos del 0.1%.
H2S ![]() 2H+ + S²-
2H+ + S²-
Halogenuros de Azufre
| Fluoruro | Propiedades | Cloruro | Propiedades |
| S2F2 | p.f. -165°c; p.e. -10.6°c | S2Cl2 | p.f. -80°c; p.e. 138°c |
| SF2 | SCl2 | p.f. -78°c; p.e. 59°c | |
| S2F4 | |||
| SF4 | p.f. 121°c; subl. -65°c | SCl4 | se descompone a -31°c |
| SF6 | subl. -65°c; p.f. -51°c | ||
| S2F10 | p.f. -53°c; p.e 29°c |
| Bromuro | Propiedades | Yoduro | Propiedades |
| S2Br2 | p.f. -46°c; desc. 90°c | S2I2 | se descompone a -30°c |
Óxidos:
Monóxido de azufre; monóxido de diazufre: El birradical SO, extremadamente reactivo se puede obtener por calentamiento de los óxidos de tirano. Este y el dímero (SO)2 sólo tienen milisegundos de vida.
El monóxido de diazufre es un gas incoloro que se puede obtener por calentamiento de CuO y S8 en el vacío, o pasar SO2Cl2 sobre Ag2S en caliente. Es mas estable que el SO y se puede mantener a baja presión hasta por unos días, pero se polimeriza fácilmente a bajas temperaturas. Tiene la estructura angular SSO.
Dióxidos. Los dióxidos se obtienen quemando los elementos en el aire, aunque también se forman pequeñas cantidades de SO3 cuando se quema azufre. También se produce dióxido de azufre al calcinar muchos disulfuros en el aire y cuando se queman combustibles que contienen azufre (petróleos y carbón mineral).
El dióxido de azufre es un débil reductor en soluciones ácidas, pero poderoso en soluciones básicas, donde se forma el ión sulfito.
Trióxido de azufre. El SO3 se obtiene por reacción del dióxido de azufre con oxigeno molecular, una reacción favorable termodinámicamente pero muy lenta en ausencia de un catalizador. El SO3 reacciona vigorosamente con el agua para dar ácido sulfúrico. Comercialmente, y por razones prácticas, el SO3 se absorbe en ácido sulfúrico para dar oleum, que luego se diluye.
Ácido sulfúrico:
Anualmente se producen casi 40.000.000. de toneladas de ácido sulfúrico. Para la producción comercial se emplea el proceso de contacto. La sc que se vende comercialmente como ácido sulfúrico contiene de 96% a 98% de H2SO4 en masa y tiene una molaridad de 18M aprox.
El H2SO4 puro es un líquido aceitoso que congela a 10,4ºC y cuyo Pto. de ebullicion es de entre 290 y 317ºC, temp. a la cual se descompone lentamente en SO3 y H2O. Existen algunos puentes de Hidrogeno en el H2SO4 liquido y sólido.
Cuando se diluye el ácido sulfúrico concentrado se desprenden cantidades considerables de calor. Esto indica la afinidad del H2SO4 con el agua, en consecuencia se le utiliza como deshidratador.
La 1º disociacion es muy grande y la 2º es mucho mas pequeña.
Propiedades:
- Es muy fuerte y corrosivo para la vida de los materiales estructurales.
- Posee Pto. de ebullición alto y se puede emplear para producir ácidos volátiles como HCl y HCN.
- Es un agente oxidante suave. No se puede usar para preparar HBr o HI.
- Concentrado y en caliente disuelve al Cu.
- Es deshidratante.
Otros Ácidos
| Sulfuroso | H2SO3 |
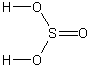 |
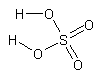
| Sulfúrico | H2SO4 |
 |
| Tiosulfúrico | H2S2O3 |
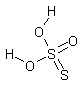 |
| Ditionoso | H2S2O4 |
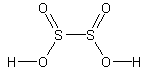 |
| Disulfuroso | H2S2O5 |
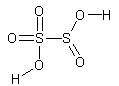 |
| Ditionico | H2S2O6 |
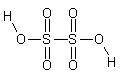 |
| Disulfúrico | H2S2O7 |
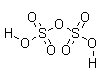 |