Introducción
Los átomos se encuentran, por lo general, formando parte de compuestos químicos en forma de moléculas, unidos entre sí mediante fuerzas de unión o de enlace. La importancia de estas fuerzas es considerable pues de ellas dependen las propiedades físicas y químicas de los compuestos. El primer modelo aceptable del enlace químico se debe a Lewis, a comienzos del siglo XX, y estaba basado en los electrones de los átomos. Todavía hoy la explicación del enlace según Lewis es aplicable a muchas moléculas simples.
La teoría de Lewis. La regla del octeto.
En 1916 Lewis relacionó el enlace químico con la compartición de un par de electrones por los átomos enlazados. De esta forma, cada pareja de electrones envuelta en un enlace debe ocupar una región del espacio entre ambos átomos, y a efectos de contabilidad, pertenecen a los dos átomos. Esto es lo que se denomina un enlace covalente, y se representa por A-B. Si existieran dos o tres pares compartidos entre dos átomos, entonces el enlace sería doble (A=B) o triple (AºB), respectivamente. Los pares de electrones no compartidos se denominan pares de electrones solitarios. Aunque éstos no contribuyen directamente al enlace, ejercen influencia en la forma de las moléculas y en sus propiedades químicas.
Lewis propuso una explicación para el enlace de un gran número de moléculas mediante la regla del octeto, según la cual, "cada átomo comparte electrones con átomos vecinos hasta alcanzar un total de ocho electrones en su capa de valencia". En realidad, esto no es mas que consecuencia de la alta estabilidad de la configuración electrónica de tipo gas noble (s2p6), también denominada de capa cerrada. El átomo de hidrógeno es una excepción a esta regla pues sólo puede llenar su capa de valencia (1s) con un máximo de 2 electrones.
La regla del octeto proporciona una forma simple de construir las denominadas estructuras de Lewis, que son diagramas que muestran el tipo de enlace en una molécula. Para poder construir una estructura de Lewis hay que seguir los siguientes pasos:
- Calcular el número de electrones que se han de incluir en la estructura sumando el número de electrones de la capa de valencia de cada átomo que constituye la molécula.
- Escribir los símbolos químicos de los átomos, de forma que se muestre cuáles están enlazados entre sí. Generalmente, el átomo menos electronegativo es el átomo central de una molécula, como ocurre en el CO2 o en el SO42-, aunque existen excepciones como las moléculas de H2O o NH3.
- Distribuir los electrones en pares de forma que haya un par de electrones entre cada dos átomos enlazados y poner, a continuación, pares electrónicos (en forma de pares solitarios o múltiples enlaces) hasta que cada átomo se encuentre rodeado de un octeto. Cada par de electrones de enlace se representa por una sola línea. La carga neta de una especie química pertenece a toda la especie química y no a un átomo en particular.
Ejemplos:
Estructura de Lewis del ion BF4¯.
B: 1s22s22p1 3 electrones de valencia.F: 1s22s22p5 7 electrones de valencia.
Los átomos aportan: 3 + (4 x 7) = 31 electrones de valencia; la carga negativa del ion representa un electrón adicional. El número de electrones totales del ion BF4¯ es de 32, lo que implica que hay que acomodar 16 pares de electrones alrededor de 5 átomos. La estructura de Lewis del ion es:
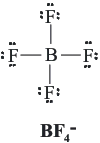
Estructura de Lewis de la molécula de CO2:
C: 1s22s22p2 4 electrones de valencia.
O: 1s22s22p4 6 electrones de valencia.
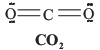
Nº electrones de valencia: 4 + (6 x 2) = 16, lo que implica que hay que acomodar 8 pares de electrones alrededor de 3 átomos. La estructura de Lewis de esta molécula es: