El oxígeno del aire es el agente oxidante más barato pero es, quizá, el más difícil de manejar en las reacciones de oxidación.
El oxígeno atmosférico reacciona constantemente con las sustancias orgánicas a la temperatura ordinaria, pero las velocidades de reacción son demasiado lentas, generalmente, para que dichas reacciones sean siempre aprovechables en síntesis química.
Para lograr que las reacciones con el oxígeno molecular puedan ser aprovechadas industrialmente hay que utilizar catalizadores, o elevar la temperatura, o ambas cosas a la vez.
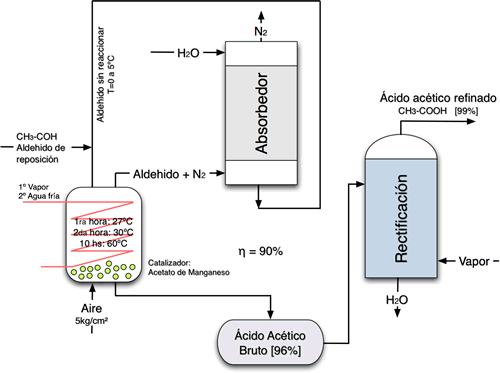
1) Oxidación del acetaldehído a ácido acético
El ácido acético se puede obtener por oxidación directa del etanol, pero en general, el ácido concentrado se suele preparar a partir de acetaldehído que, a su vez, se ha obtenido por hidratación del acetileno u oxidación del etanol.
Ordinariamente, la oxidación se efectúa en disolución de ácido acético en presencia de un catalizador, y a la presión atmosférica o a presiones un poco más elevadas.
2) Oxidación del etanol a ácido acético
La oxidación en fase líquida del etanol es el proceso principal en la fabricación de vinagre rápido.
La mejor técnica actual emplea torres de barro rellenas con virutas de madera de haya, provistas en la parte superior, de pulverizadores automáticos para la alimentación de la torre con mezcla de alcohol diluido o con disolución de malta fermentada.
La oxidación del etanol a ácido acético, catalizada químicamente, acompañada de oxidación de acetaldehído, puede conseguirse usando acetato de cobalto disuelto en ácido acético.
3) Oxidación de hidrocarburos alifáticos y sus derivados
Para oxidar con aire los hidrocarburos alifáticos de bajo peso molecular es más fácil la reacción empleando catalizadores disueltos en un disolvente capaz de disolver también el hidrocarburo. De esta manera se pueden realizar oxidaciones en fase líquida , con lo que se consigue simplificar el problema de tener que mantener una temperatura uniforme y la eliminación del calor de reacción, y se puede regular más fácilmente la oxidación regulando la presión y la velocidad de entrada del aire o el oxígeno.
Como catalizadores se suele emplear sales de Ce, Co, Cu, Mn, V, U, Fe, y como activadores sales de Ba, Mg, K; actúan de iniciadores los peróxidos, perácidos, aldehídos, cetonas, olefinas y otras sustancias orgánicas que formen peróxidos.
Un ejemplo de estos procesos es la oxidación con aire del isobutano, con catalizador de acetato de cobalto, dietilcetona como iniciador, y ácido acético como disolvente.
4) Oxidación de hidrocarburos líquidos obtenidos del petróleo.
Estos procesos de oxidación pueden llevarse a cabo en fase líquida empleando como catalizadores sales solubles de manganeso, cobre, hierro, cromo y vanadio. Se opera a temperaturas entre 100 y 160 ºC utilizando como oxidantes el aire o el oxígeno gaseoso.
La finalidad principal de estos procesos se centra en la preparación de ácidos grasos, que se utilizan para la producción de jabones, grasas, ésteres, disolventes, etc., o que por hidrogenación pueden producir alcoholes de elevado peso molecular, los cuales, a su vez, por sulfonación pueden dar lugar a distintos detergentes de gran aplicación práctica. Un ejemplo de estos procesos es la oxidación de la parafina dura y otro hidrocarburos de parecido peso molecular.
5) Oxidación del ciclohexano
Para la oxidación directa del ciclohexano a ácido adípico, pueden utilizarse como catalizadores sales de todos los metales, con pesos atómicos entre 50 y 200. Utilizando estos catalizadores en presencia de un disolvente orgánico ácido (para tener disuelto el hidrocarburo) y con ayuda de un peróxido que actúa como iniciador de la reacción se han podido obtener rendimientos de ácido dicarboxílico que llegan hasta el 50%. Durante la reacción, que dura de 5 a 6 horas, se hace pasar corriente de aire que burbujea a través de la mezcla líquida.