El nitrógeno es el elemento, en forma no elemental, más abundante en nuestro planeta. Se encuentra principalmente en la atmósfera, donde constituye el 78.1 % en volumen. Su abundancia en la corteza terrestre es sólo del 0,002% en masa. Los únicos minerales importantes que contienen nitrógeno son el KNO3 (nitro o salitre) y el NaNO3 (nitrato de sodio o nitrato de Chile), localizados en unas pocas regiones desérticas. Otras fuentes naturales que contienen nitrógeno son las proteínas de plantas y animales y restos fosilizados de plantas vivas como el carbón.
El nitrógeno gas fue identificado inicialmente como ese componente del aire que impedía la respiración o la combustión. Por eso se le dio el nombre de azote (sin vida) en francés e italiano. El elemento nitrógeno se presenta libre en la naturaleza en forma molecular: el dinitrógeno, gas incoloro e inodoro. Es un gas inerte, poco soluble en el agua; su solubilidad aumenta con la presión lo cual representa un problema para los submarinistas.
Hasta hace aproximadamente 100 años las fuentes de nitrógeno puro y sus compuestos eran bastante limitadas. Esto cambió totalmente con el descubrimiento de un proceso para la licuación del aire en 1895 y de un proceso para convertir el nitrógeno en amoniaco en 1908 (proceso Haber).
Mediante la destilación del aire se obtienen unos 30 millones de tn/año de nitrógeno. En este proceso el aire previamente licuado se calienta gradualmente. Cada uno de los gases que componen el aire tiene un punto de ebullición diferente, lo que permite separarlos gradualmente. El N2 tiene un punto de ebullición de -195.8 ºC. Este método produce N2 de alta pureza (< 20 ppm de O2).
A menor escala, se puede preparar separándolo del oxígeno atmosférico mediante el uso de membranas o con Zeolitas. Algunas zeolitas absorben selectivamente N2 que puede ser liberado cuando se calientan.
A escala de laboratorio, se puede obtener por descomposición térmica de sales nitrogenadas como el nitrito amónico:
NH4NO2 (ac) → N2 (g) + 2 H2O (l)
También se puede obtener nitrógeno con un alto grado de pureza por descomposición térmica de la azida de sodio (300 oC)
2 NaN3 → 2 Na + 3 N2
La elevada energía asociada a la molécula de dinitrógeno es la responsable de su estabilidad:
NºN (g) → 2 N(g) ΔHº = +945,4 kJ/mol
La reacción de disociación es muy endotérmica. Además las entalpías de formación de muchos compuestos de nitrógeno son positivas, lo que significa que sus reacciones de formación son endotérmicas. Para el NO(g)
½ N2(g) + ½ O2(g) → NO(g) ΔHº = +90,25 kJ/mol
Esta reacción (y la mayoría de las reacciones muy endotérmicas) no transcurren de manera apreciable a temperaturas normales.
No obstante la molécula de N2(g) se vuelve más reactiva a temperaturas elevadas o en presencia de catalizadores. El único elemento químico que reacciona con N2(g) a temperatura ambiente es el litio, formándose el nitruro de litio:
N2(g) + 6 Li(s) → 2 Li3N(s)
El dinitrógeno se utiliza fundamentalmente para los siguientes fines:
- Para proporcionar atmósferas inertes, exentas de otros gases más reactivos como el dioxígeno. Protección de componentes electrónicos durante su fabricación o almacenamiento. Se añade a las botellas de vino cuando se les quita el tapón para prevenir la oxidación del vino. Las manzanas se pueden mantener a bajas temperaturas y en atmósfera de nitrógeno durante más de 30 meses También se utiliza en la fabricación de acero, en el purgado de hidrocarburos inflamables en refinerías y oleoductos, etc.
- Fabricación de amoníaco y otros compuestos nitrogenados.
- El nitrógeno líquido se utiliza como líquido criogénico (P eb = 77.3 K) para conservar por ejemplo especímenes biológicos. Debido a su inercia química y su bajo coste también se utiliza como refrigerante ideal para experiencias que necesiten muy bajas temperaturas: ensayos de superconductividad eléctrica de materiales.
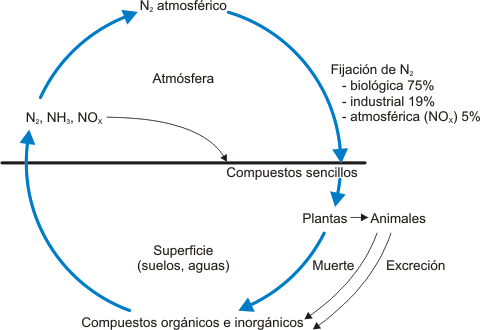
El ciclo del nitrógeno
El ciclo del nitrógeno es uno de los grandes ciclos biogeoquímicos que rigen en el planeta Tierra y, también, es uno en los que la actividad humana interviene en mayor grado. Una de las etapas de este ciclo es la fijación de nitrógeno, conversión del nitrógeno en compuestos asimilables por los vegetales, y que se da mediante tres procesos:
1. Descargas eléctricas que activan la molécula de dinitrógeno (Cantidad poco importante; tiene lugar a alta temperatura).
½ N2(g) + ½ O2(g) → NO(g)
2. Fijación de nitrógeno por las bacterias. Estas bacterias producen una enzima, la nitrogenasa, que convierte el dinitrógeno en amoníaco.
Estos dos primeros procesos son procedimientos naturales de obtención de nitrógeno.
3. Actividad humana. Procesos de síntesis que consumen nitrógeno:
- Proceso Haber-Bosch: N2+ 3 H2 → 2 NH3.
- Proceso Ostwald: NH3 → → → HNO3
Los suelos a su vez pierden nitrógeno por los siguientes procesos:
- Absorción de nitrógeno por las plantas
- Bacterias desnitrificantes: nitratos → nitritos → NO2 → N2 → NH3
- Arrastre por aguas superficiales
El nitrógeno de la atmósfera se recicla en la naturaleza bajo dos formas principales: el amoníaco y los nitratos. Sólo algunas bacterias y las leguminosas son capaces de utilizar el nitrógeno directamente del aire para efectuar la síntesis de sus aminoácidos y proteínas. La mayoría de los vegetales son incapaces de efectuar esta transformación y utilizan pues un intermedio: los nitratos. Estos nitratos, que las plantas absorben del suelo a través de sus raíces, son aportados al suelo de diferentes formas: por las bacterias nitrificantes, por la fijación llevada a cabo en las nudosidades de las leguminosas, por la contaminación atmosférica (generadora de óxidos de nitrógeno) llevados al suelo por el agua de lluvia y los efluentes industriales y urbanos. El aporte selectivo se realiza en forma de abonos (ya sea sintéticos u orgánicos). Todos estos aportes rebasan la cantidad que las plantas utilizan para su crecimiento y, aunque parte de este exceso es reciclado por las bacterias desnitrificantes, la mayor parte penetra en el suelo por lavado y alcanza los mantos freáticos contaminándolos.