Como ácido
El ácido sulfúrico diluido se utiliza habitualmente como un ácido diprótico fuerte:
H2SO4 (ac) + H2O(l) → H3O+ (ac) + HSO4-(ac) K1=103equilibrio predominante
HSO4-(ac) + H2O(l) → H3O+ (ac) + SO42- (ac) K2=1.2 10-2
Reacciona con la mayor parte de los metales para formar sulfatos liberando H2(g). Reacciona con las bases para formar sulfatos y agua.
H2SO4 (ac) + Zn (s) → ZnSO4 (ac) + H2 (g)
Deshidratante
La presión de vapor de agua permitida por el ácido sulfúrico es muy baja y por eso se utilizan en desecadores. El ácido sulfúrico concentrado elimina el H2O de un gran número de compuestos en una reacción extremadamente exotérmica:
H2SO4 (l) + H2O (l) DHº = - 880 kJ mol-1
Es espectacular la reacción por la cual el azúcar o el papel (carbohidratos: Cx(H2O)y se convierten en carbón y agua.
C12H22O11 (s) + H2SO4 (l) → 12 C (s) + 11 H2O (g) + H2SO4 (ac)
Cuando el ácido sulfúrico toca la piel humana, las moléculas que la integran pierden agua inmediatamente lo que produce la quemadura. Nunca hay que tratar de aliviarla con agua dado que lo único que conseguiríamos es agravarla.
Oxidante
En caliente y concentrado es un agente oxidante moderadamente fuerte. Por ejemplo es capaz de oxidar al Cu. En realidad, las propiedades oxidantes observadas se deben a la presencia de SO3, por eso el poder oxidante disminuye con la concentración ya que desaparecen las moléculas de SO3 para forman HSO4- y SO4-2. El poder oxidante de las especies presentes en las disoluciones de ácido sulfúrico disminuye en el orden:
SO3 > H2SO4 > HSO4- > SO4-2
El ácido sulfúrico concentrado disuelve metales menos reductores que el hidrógeno como Cu, Hg, Ag, con desprendimiento de SO2 y formación de sulfato. En cambio, como ya hemos dicho, el ácido sulfúrico diluido disuelve metales más reductores que el hidrógeno: Fe, Zn, Al, etc., con desprendimiento de hidrógeno.
Agente sulfonante
De gran utilidad en Química Orgánica:
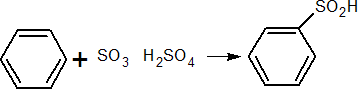
Como base
Un ácido de Brønsted-Lowry puede actuar como base si se enfrenta a un dador de protones más fuerte. Sólo ácidos extremadamente fuertes (SUPERACIDOS) pueden forzar al H2SO4 a aceptar protones.
H2SO4 + HSO3F ⇔ H3SO4+ + SO3F-
Usos del ácido sulfúrico
El ácido sulfúrico es notablemente económico, en gran parte porque cada paso en el proceso es exotérmico –combustión de S (ΔHº = -297 kJ/mol), oxidación de SO2 (ΔHº = -99 kJ/mol), hidratación del SO3 (ΔHº = -132 kJ/mol)- y el calor es un producto secundario valioso. Tres cuartas partes del calor generado en el proceso se venden como vapor, y el resto se usa para bombear los gases a través de la planta. Una planta típica que fabrica 825 toneladas de H2SO4 por día produce suficiente vapor para generar 7 x 106 watios de electricidad. Entre las aplicaciones del ácido sulfúrico cabe destacar:
La fabricación de fertilizantes fosforados y nitrogenados (61% producción).
- Producción de productos químicos (19%) como detergentes, resinas, fármacos, alimentos, insecticidas, anticongelantes, etc.
- Fabricación de explosivos, caucho sintético, baterías (7 %).
- Fabricación de titanio y otros pigmentos (pinturas) (6%)
- Fabricación del rayón y películas (3%)
- Industria del petróleo (2%)
- Fabricación de hierro y acero (2%)