Peróxido de hidrógeno: H2O2
El peróxido de hidrogeno, también llamado agua oxigenada, es una sustancia líquida (Tfus=-0.43º y Teb=150ºC). Tiene un punto de ebullición más alto que agua, así que las disoluciones se pueden concentrar por evaporación. A temperatura ambiente, es un líquido azul pálido casi incoloro y viscoso (consecuencia del enlace por puentes de hidrógeno, d = 1.44 g/cc). A concentraciones elevadas es extremadamente corrosiva y por tanto en esas condiciones debe ser utilizada con gran precaución. Es una sustancia más ácida que el H2O (Ka = 1.5 10-12).
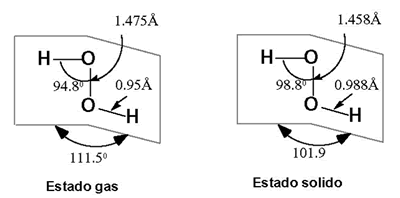
La geometría molecular se presenta en los esquemas que siguen. Las moléculas tienen una estructura no plana (en forma de libro) cuyo momento dipolar es mayor que el del agua. El ángulo diédrico varia notablemente entre estado gaseoso o sólido.
Es termodinámicamente inestable respecto a la descomposición: (ver diagrama de Frost)
H2O2(l) → H2O(l) + 1/2 O2(g) ΔG = -119.2 kJ mol-1
Cuando está pura el proceso de descomposición es lento debido a factores cinéticos (el mecanismo de reacción supone una muy elevada energía de activación). Pero casi cualquier cosa (iones metálicos de transición, metales, sangre, polvo) es capaz de catalizar su descomposición. Incluso los pocos iones que una botella de vidrio libera en la disolución son capaces de iniciar dicha descomposición. Esta es la razón por la que se debe guardar en botellas de plástico. Un simple calentamiento también induce una rápida descomposición. Se suele añadir como estabilizador por ser un agente quelante como el AEDT.
El peróxido de hidrógeno es soluble en agua en todas proporciones. Usualmente se adquiere el agua oxigenada en solución acuosa al 30% o 120 volúmenes. (Esto indica que por la descomposición del H2O2 contenido en un litro de disolución se formarían 120 litros de oxígeno medido en condiciones estándar según la reacción de descomposición). Al igual que el agua, es un buen disolvente de compuestos iónicos pero presenta el inconveniente ya señalado de que puede descomponerse fácilmente en su presencia.
El peróxido de hidrogeno es un fuerte oxidante en medio ácido y, en menor medida en medio básico.
| R-1 | H2O2 |
+ 2H+ | + 2e− | → |
2H2O | Eº = 1,78 V |
| R-2 | O2 |
+ 4H+ | + 4e− | → |
2H2O | Eº = 1,23 V |
| R-3 | O2 |
+2H+ | + 2e− | → |
H2O2 | Eº = 0,70 V |
| R-4 | O2 |
+2H2O | + 4e− | → |
H2O2 | Eº = 0,40 V |
| R-5 | OH2− |
+ H2O | + 2e− | → |
3OH− | Eº = 0,88 V |
| R-6 | O2 |
+ H2O | + 2e− | → |
OH2− + OH− | Eº = -0,076 V |
De la primera reacción (R-1) podemos inferir que el peróxido de hidrógeno puede actuar como un oxidante fuerte. Dado que el estado de oxidación en el peróxido es (-1), tambien puede oxidarse a O2 y por tanto puede actuar también como reductor (R-3).
Como agente oxidante
M. ácido 2 Fe+2 + H2O2 + 2 H+ → 2 Fe+3 + 2 H2O
M. básico 2 Mn+2 + 2 H2O2 → 2 MnO2 + H2O
Como agente reductor
M. ácido 2 MnO4- + 5H2O2 + 6 H+ → 2 Mn+2 + 8H2O + 5O2
HClO + H2O2 → H3O+ + Cl- + O2
M. básico 2 Fe(CN)6-3 + H2O2 + 2OH- → 2Fe(CN)6-4 + 2H2O + 5O2
Cl2 + H2O2 + 2OH- → 2 Cl- + 2H2O+ O2
Termodinámicamente es mejor oxidante que reductor. Las reacciones de oxidación se suelen llevar a cabo en medio ácido mientras que las de reducción en medio básico. Se comporta como reductor frente a oxidantes fuertes como el MnO4-.
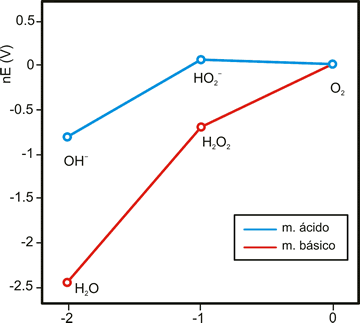
El diagrama de Frost muestra que H2O2 es inestable frente a su dismutación, tanto en medio ácido como básico. En la práctica, a temperaturas moderadas, no se descompone a menos que haya presente trazas de metales que catalizan su descomposición. La mayoría de catalizadores de esta reacción son pares redox en los que la forma oxidada puede reducir al H2O2 mientras que la forma reducida puede reducir al H2O2. Viendo el diagrama de Frost vemos que cualquier par con potencial 0.695<Eº<1.77 V en medio ácido puede catalizar la reacción de descomposición del peróxido de hidrógeno.
Fe3+/Fe2+, Eº +0.771V
2Fe3+ + H2O2 → 2Fe2+ + O2 +2H+; Eº= +0.08V
2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2H2O; Eº = +1.0V
2H2O2 → 2H2O + O2
El peróxido de hidrógeno tiene una química rica y variada consecuencia de:
(i) La capacidad para actuar tanto como agente oxidante como reductor en medio ácido y en medio básico. Se oxida con MnO4-2 y Ce+4 dando O2
(ii) La capacidad para actuar en reacciones ácido base dando sales de peroxonio (H2OOH)+, hidroperóxidos (OOH)-, y peróxidos (O2)-. El peróxido de hidrógeno es un ácido más fuerte que el agua y en disoluciones diluidas tiene un pka (20 ºC) de 11.75.
H2O2 + H2O ![]() H3O+ + OOH-
H3O+ + OOH-
ácido base
Del mismo modo, el H2O2 es una base más débil que el H2O, estando el siguiente equilibrio desplazado hacia la derecha:
H3O2+ + H2O ![]() H2O2 + H3O+
H2O2 + H3O+
Esta propiedad de el agua oxigenada de dar reacciones ácido base permite la obtención de sales de peroxonio (H2OOH+), hidroperóxidos (OOH-), y peróxidos (O2-). En el caso concreto de ion hidroperóxido, éste se obtiene por desprotonación del H2O2. Los hidro peróxidos de los metales alcalinos, MOOH, se conocen en disolución. El NH3 líquido también es capaz de desprotonar el H2O2 conduciendo a la formación del NH4+OOH-, sólido de color blanco que presenta un punto de fusón de 25 ºC.
(iii) La capacidad para formar complejos peroxometal y aniones peroxoácido.
Cr2O72- + 2H+ + 4H2O2 → 2CrO(O2)2 + 5H2O
Obtención del peróxido de hidrógeno
Fue preparado pro primera vez en 1818 mediante la siguiente reacción química:
BaO2 + H2SO4 ® BaSO4 (s) + H2O2
Posteriormente se preparó mediante hidrólisis de peroxidisulfatos, procedente de la electrolisis de bisulfatos:
Cátodo: 2 H+ (ac) + 2 e- H2(g)
Ánodo: 2 HSO4- (ac) 2H+(ac) + S2O82- (ac) + 2e-
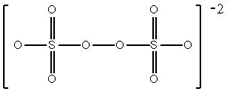
Hidrólisis: S2O82- (ac) + 2 H2O (l) → H2O2 (ac) + 2 HSO4- (ac)
Este proceso se utiliza en la actualidad tan sólo cuando se quiere preparar, a escala de laboratorio, el peróxido de deuterio D2O2:
K2S2O8 + 2 D2O → D2O2 + 2 KDSO4
Preparación industrial:
Existen tres procesos industriales para preparar H2O2:
- Oxidación del isopropanol
- Oxidación electroquímica del H2SO4 o (NH4)2SO4
- Proceso de la antraquinona (el más importante)
Método de la oxidación del isopropanol
No hace muchos años la compañía multinacional Shell desarrolló un nuevo procedimiento, "proceso del isopropanol", donde se utiliza a este alcohol utiliza como producto de partida. El rendimiento es del 30 %.
CH3-CHOH-CH3 + O2 → CH3-CO-CH3 + H2O2
(90-140ºC, 15-20 atm)
El rendimiento es tan bajo debido a reacciones colaterales. El peróxido de hidrógeno se separa por destilación fraccionada. Se obtiene así una disolución de H2O2 al 20 % en peso. La gran desventaja de este proceso es que se obtienen doble peso de acetona que de H2O2.
Método de la oxidación electroquímica del H2SO4 o (NH4)2SO4
El peróxido de hidrógeno se maneja ordinariamente en forma de disolución al 3%. Esta disolución se obtiene por electrolisis del ácido sulfúrico concentrado (550 a 570 g/L) o de ácido sulfúrico (260 g/l), lo que origina el ácido peroxodisulfúrico H2S2O8, hidrolizando después el ácido y destilando el peróxido de hidrógeno obtenido:
Electrolisis:
Cátodo: 2 H+ (ac) + 2 e- ® H2(g)
Ánodo: 2H2SO4- (ac) → 2 H+(ac) + H2S2O82- (ac) + 2e-
2H2SO4- (ac) → H2S2O8(ac) + H2
Con (NH4)2SO4 (210 a 220 g/l):
(NH4)2SO4 + H2SO4 (ac) → (NH4)2S2O8(ac) + H2
Hidrólisis:
H2S2O8(ac) + H2O → H2SO5 + H2SO4
H2SO5 + H2O → H2SO4 + H2O2
El rendimiento del proceso del 70 %. La desventaja del proceso es el coste de la electricidad y de la producción.
Proceso de la antraquinona (el más importante)
Se obtiene por reducción de alquilantraquinona. La posterior oxidación con aire del 2-alquilantrahidroquinona formado regenera la etilantraquinona con formación de peróxido de hidrógeno, que se extrae con agua. Esta debe estar perfectamente desionizada y contener un estabilizador de H2O2 (pirofosfato o estannato de sodio). Las disoluciones de H2O2 se concentran en vacío, obteniéndose concentraciones que varían entre el 15 % y el 35% en peso.
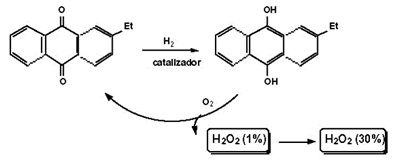
La hidroantranquinona requiere de disolventes aromáticos mientras que la antraquinona requiere disolventes polares tipo alcohol o ésteres. Ello conlleva el uso de mezclas complejas de disolventes, que suelen ser costoso, de manera que hay que recuperarlos. La naturaleza del radical R depende del fabricante. Se emplean R = Et, terc-Bu, etc.
El catalizador de la fase de hidrogenación es de paladio. La reacción se efectúa a 40 ºC y a presiones de 5 bar. El rendimiento de la reacción es del 98 %. La producción mundial es de alrededor de 106 tn/año.
Aplicaciones del H2O2
Se utiliza en la fabricación de otros productos químicos (30%) y de productos de limpieza (20%)
Su principal uso es como oxidante, en especial, como agente blanqueante de pasta de papel y textiles (30%) (Las sustancias de origen animal (lana, pelos, pieles) se deterioran con otros agentes de blanqueo como el hipoclorito, o SO2)
En el laboratorio se usa en la oxidación de azufre, nitrógeno y yoduros.
Se utiliza como germicida (dis. al 3%): destruye gérmenes patógenos. Inhibe el crecimiento de todos los gérmenes anaerobios. Actúa como desodorante y antiséptico bucal. Destrucción de materia orgánica.
Blanqueante de pinturas. Un pigmento blanco frecuente tiene de composición Pb3(OH)2(CO3)2 se deteriora por efecto de la polución generando PbS negro. El proceso de restauración consiste en la oxidación del sulfuro con agua oxigenada:
PbS (s) + 4 H2O2 → PbSO4 + 4 H2O