Se define la entalpía de ganancia de electrones como la variación de la energía asociada a la ganancia de un electrón por un átomo en estado gaseoso:
A(g) + e-(g) → A-(g) ΔHge
Esta entalpía puede ser positiva o negativa (reacción endotérmica o exotérmica, respectivamente). Sin embargo, aunque DHge es el término termodinámico apropiado para describir este proceso, en Química Inorgánica se suele emplear más frecuentemente una propiedad íntimamente relacionada con la anterior, denominada afinidad electrónica Ae, que se define como la diferencia en energía expresada a continuación:
Ae = E(A, g) - E(A-,g)
A T = 0 K, la afinidad electrónica es el valor, cambiado de signo, de la entalpía de ganancia de electrones (Ae= -ΔHge). Un valor positivo de la afinidad electrónica indica que el ion A- tiene una menor y, por tanto más favorable, energía que el átomo neutro A. Como ocurre con la energía de ionización, la afinidad electrónica se suele expresar en eV.
La afinidad electrónica de un elemento está determinada, en parte, por la energía del orbital desocupado, o parcialmente ocupado, de menor energía en el estado fundamental del átomo. Este orbital es uno de los denominados orbitales frontera de un átomo; otro orbital frontera corresponde al orbital lleno de mayor energía. Los orbitales fronteras de un átomo están implicados en los cambios electrónicos que se producen cuando se forman los enlaces químicos.
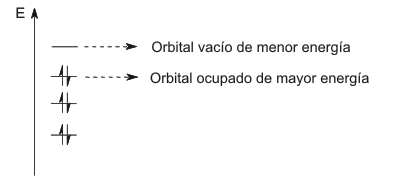
Orbitales Frontera
Un elemento posee una elevada afinidad electrónica si el electrón adicional ocupa una capa en la que experimenta una elevada carga nuclear efectiva. Este es el caso de los elementos que se encuentran en la parte superior derecha de la Tabla Periódica. Estos elementos próximos al flúor (específicamente el nitrógeno, el oxígeno y el cloro) son los que poseen los mayores valores de Ae. La segunda afinidad electrónica, o energía de adición de un segundo electrón, para un elemento es siempre positiva porque las repulsiones interelectrónicas son mayores que las fuerzas de atracción por el núcleo.