Para cualquier electrón en un átomo se verifica que cuanto más cerca del núcleo se acerque dicho electrón, mayor será la carga nuclear efectiva que experimente. Bajo esta premisa, considérese un electrón 2s del litio. Si este electrón estuviera fuera de la capa 1s (que contiene dos electrones), entonces la carga neta que experimentaría sería: 3 (núcleo) - 2 (electrones 1s) = 1. Sin embargo, experimentalmente se conoce que este electrón está atraído más fuertemente de lo que correspondería a esta Zef. La explicación se basa en que en realidad el electrón del orbital 2s penetra en la capa 1s, con lo que la carga nuclear efectiva es mayor ya que los dos electrones 1s no apantallan totalmente. La figura muestra la función de distribución radial para los orbitales 2s y 2p. La zona sombreada corresponde a la capa 1s. Es evidente que el electrón en el orbital 2s penetra mucho más en la capa 1s que el 2p, por lo que la carga nuclear efectiva será mayor. En consecuencia, la ocupación del orbital 2s está más favorecida en términos energéticos que la del 2p, y el orden de energía es, pues 2s<2p.
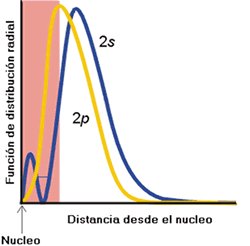
Penetración de orbitales 2s y 2p
Valores de carga nuclear efectiva para Z = 1-18.
H |
He |
|||||||
|---|---|---|---|---|---|---|---|---|
Z |
1 |
2 |
||||||
1s |
1.00 |
1.69 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
|---|---|---|---|---|---|---|---|---|
Z |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
1s |
2.69 |
3.68 |
4.68 |
5.67 |
6.66 |
7.66 |
8.65 |
9.64 |
| 2s | 1.28 |
1.91 |
2.58 |
3.22 |
3.85 |
4.49 |
5.13 |
5.76 |
| 2p | 2.42 |
3.14 |
3.83 |
4.45 |
5.10 |
5.76 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
|
|---|---|---|---|---|---|---|---|---|
Z |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
1s |
10.63 |
11.61 |
12.59 |
13.57 |
14.56 |
15.54 |
16.52 |
17.51 |
| 2s | 6.57 |
7.39 |
8.21 |
9.02 |
9.82 |
10.63 |
11.43 |
12.23 |
| 2p | 6.80 |
7.83 |
8.96 |
9.94 |
10.96 |
11.98 |
12.99 |
14.01 |
| 3s | 2.51 |
3.31 |
4.12 |
4.90 |
5.64 |
6.37 |
7.07 |
7.76 |
| 3p | 4.07 |
4.29 |
4.89 |
5.48 |
6.12 |
6.76 |
Este orden de energía encontrado para los orbitales 2s y 2p del litio es también característico de otros átomos polielectrónicos, como puede verse en la tabla. Como regla general, el valor de Zef tiende a aumentar a lo largo de un periodo con el número atómico. Asimismo, el electrón s de la capa más externa de un átomo está menos apantallado que el electrón p de la misma capa: el flúor presenta Zef de 5.13 para el electrón 2s y 5.10 para el electrón 2p. De forma análoga, la carga nuclear efectiva es mayor para un electrón en un orbital np que para otro en un orbital nd. Como resultado de la penetración de los orbitales y del apantallamiento el orden de energías en los átomos polielectrónicos es típicamente: ns < np < nd < nf, dado que en una misma capa los orbitales que más penetran son los de tipo s y los que están menos próximos al núcleo son los de tipo f. El efecto global de estos dos factores se conjugan dando lugar a un orden de energías que se muestra en las siguientes figuras.
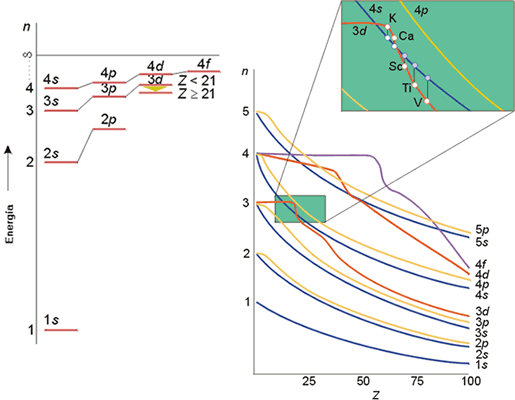
Orden de energía de los orbitales hidrogenoides empleados como aproximación en átomos polielectrónicos.
Obsérvese como existen variaciones en el orden de energías entre los orbitales 3d y 4s dependiendo del nº de electrones. Así, por ejemplo, para K y Ca la energía del orbital 4s es menor que la de los 3d, debido al poder penetrante de los orbitales 4s, mientras que desde el Sc hasta el Zn, los orbitales 3d están por debajo de los 4s.
Las configuraciones electrónicas y el principio de construcción.
Las configuraciones electrónicas del estado fundamental de los diferentes átomos polielectrónicos se pueden determinar experimentalmente mediante técnicas espectroscópicas. Para poder construir la configuración electrónica de un átomo hay que tener en cuenta tanto el principio de exclusión de Pauli como la distribución de los niveles de energía que resultan de considerar los efectos de la penetración y del apantallamiento. El principio de construcción o aufbau (del alemán construcción) es un procedimiento que conduce a la configuración del estado fundamental de un átomo polielectrónico. Según este principio, los orbitales de los átomos neutros se van ocupando según el orden determinado por el número cuántico principal y los efectos de la penetración y del apantallamiento, o lo que es lo mismo, conduciendo a la ocupación de los orbitales que minimizan la energía del sistema. El orden general de energía de los orbitales es el siguiente:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<5d»4f<6p<7s<6d<5f<...
Cada
orbital puede acomodar hasta un máximo de dos electrones. Así, los tres
orbitales de la subcapa p pueden alojar un total de 6 electrones y los
cinco orbitales d hasta un máximo de 10 electrones.
De acuerdo con este principio las configuraciones electrónicas de los cinco
primeros elementos serían:
| H: 1s1 | He: 1s2 | Li: 1s22s1 | Be:1s22s2 | B:1s22s22p1 |
Cuando hay más de un orbital con la misma energía, que puede ser ocupado, tal y como ocurre en la ocupación de los orbitales 2p del B al C, se tiene en cuenta el Principio de Máxima Multiplicidad de Hund: "si existieran más de un orbital con la misma energía, los electrones ocuparán el máximo de dichos orbitales y sus espines serán paralelos". La ocupación de orbitales separados como los px y py puede entenderse en términos de disminuir las repulsiones interelectrónicas que se originan cuando dos electrones ocupan el mismo orbital (la misma región del espacio). El requerimiento de los espines paralelos, para electrones que ocupan diferentes orbitales, es una consecuencia del efecto mecánico-cuántico llamado correlación de espín, o tendencia de dos electrones con espines paralelos a permanecer separados uno del otro y disminuir la repulsión entre ellos.
Teniendo en cuenta estas reglas, la configuración electrónica del estado fundamental del C es 1s22s22px12py1 (es arbitrario cual de los orbitales p se ocupa antes pues todos son degenerados; generalmente se adopta el orden alfabético px, py, pz) o, de forma más abreviada, 1s22s22p2. Las configuraciones electrónicas de los elementos aparecen en la tabla que se encuentra a continuación.
Configuración electrónica de los elementos
Z |
Elemento |
Configuración
Electrónica |
Z |
Elemento |
Configuración
Electrónica |
|---|---|---|---|---|---|
1 |
H |
1s1 | 53 |
I |
[Kr]4d105s25p5 |
2 |
He |
1s2 | 54 |
Xe |
[Kr]4d105s25p6 |
3 |
Li |
[He]2s1 | 55 |
Cs |
[Xe]6s1 |
4 |
Be |
[He]2s2 | 56 |
Ba |
[Xe]6s2 |
5 |
B |
[He]2s22p1 | 57 |
La |
[Xe]5d16s2 |
6 |
C |
[He]2s22p2 | 58 |
Ce |
[Xe]4f15d16s2 |
7 |
N |
[He]2s22p3 | 59 |
Pr |
[Xe]4f36s2 |
8 |
O |
[He]2s22p4 | 60 |
Nd |
[Xe]4f46s2 |
9 |
F |
[He]2s22p5 | 61 |
Pm |
[Xe]4f56s2 |
10 |
Ne |
[He]2s22p6 | 62 |
Sm |
[Xe]4f66s2 |
11 |
Na |
[Ne]3s1 | 63 |
Eu |
[Xe]4f76s2 |
12 |
Mg |
[Ne]3s2 | 64 |
Gd |
[Xe]4f75d16s2 |
13 |
Al |
[Ne]3s23p1 | 65 |
Tb |
[Xe]4f96s2 |
14 |
Si |
[Ne]3s23p2 | 66 |
Dy |
[Xe]4f106s2 |
15 |
P |
[Ne]3s23p3 | 67 |
Ho |
[Xe]4f116s2 |
16 |
S |
[Ne]3s23p4 | 68 |
Er |
[Xe]4f126s2 |
17 |
Cl |
[Ne]3s23p5 | 69 |
Tm |
[Xe]4f136s2 |
18 |
Ar |
[Ne]3s23p6 | 70 |
Yb |
[Xe]4f146s2 |
19 |
K |
[Ar]4s1 | 71 |
Lu |
[Xe]4f145d16s2 |
20 |
Ca |
[Ar]4s2 | 72 |
Hf |
[Xe]4f145d26s2 |
21 |
Sc |
[Ar]3d14s2 | 73 |
Ta |
[Xe]4f145d36s2 |
22 |
Ti |
[Ar]3d24s2 | 74 |
W |
[Xe]4f145d46s2 |
23 |
V |
[Ar]3d34s2 | 75 |
Re |
[Xe]4f145d56s2 |
24 |
Cr |
[Ar]3d54s1 | 76 |
Os |
[Xe]4f145d66s2 |
25 |
Mn |
[Ar]3d54s2 | 77 |
Ir |
[Xe]4f145d76s2 |
26 |
Fe |
[Ar]3d64s2 | 78 |
Pt |
[Xe]4f145d96s1 |
27 |
Co |
[Ar]3d74s2 | 79 |
Au |
[Xe]4f145d106s1 |
28 |
Ni |
[Ar]3d84s2 | 80 |
Hg |
[Xe]4f145d106s2 |
29 |
Cu |
[Ar]3d104s1 | 81 |
Tl |
[Xe]4f145d106s26p1 |
30 |
Zn |
[Ar]3d104s2 | 82 |
Pb |
[Xe]4f145d106s26p2 |
31 |
Ga |
[Ar]3d104s24p1 | 83 |
Bi |
[Xe]4f145d106s26p3 |
32 |
Ge |
[Ar]3d104s24p1 | 84 |
Po |
[Xe]4f145d106s26p4 |
33 |
As |
[Ar]3d104s24p3 | 85 |
At |
[Xe]4f145d106s26p5 |
34 |
Se |
[Ar]3d104s24p4 | 86 |
Rn |
[Xe]4f145d106s26p6 |
35 |
Br |
[Ar]3d104s24p5 | 87 |
Fr |
[Rn]7s1 |
36 |
Kr |
[Ar]3d104s24p6 | 88 |
Ra |
[Rn]7s2 |
37 |
Rb |
[Kr]5s1 | 89 |
Ac |
[Rn]6d17s2 |
38 |
Sr |
[Kr]5s2 | 90 |
Th |
[Rn]6d27s2 |
39 |
Y |
[Kr]4d15s2 | 91 |
Pa |
[Rn]5f26d17s2 |
40 |
Zr |
[Kr]4d25s2 | 92 |
U |
[Rn]5f36d17s2 |
41 |
Nb |
[Kr]4d45s1 | 93 |
Np |
[Rn]5f46d17s2 |
42 |
Mo |
[Kr]4d55s1 | 94 |
Pu |
[Rn]5f67s2 |
43 |
Tc |
[Kr]4d55s2 | 95 |
Am |
[Rn]5f77s2 |
44 |
Ru |
[Kr]4d75s1 | 96 |
Cm |
[Rn]5f76d17s2 |
45 |
Rh |
[Kr]4d85s1 | 97 |
Bk |
[Rn]5f97s2 |
46 |
Pd |
[Kr]4d10 | 98 |
Cf |
[Rn]5f107s2 |
47 |
Ag |
[Kr]4d105s1 | 99 |
Es |
[Rn]5f117s2 |
48 |
Cd |
[Kr]4d105s2 | 100 |
Fm |
[Rn]5f127s2 |
49 |
In |
[Kr]4d105s25p1 | 101 |
Md |
[Rn]5f137s2 |
50 |
Sn |
[Kr]4d105s25p2 | 102 |
No |
[Rn]5f147s2 |
51 |
Sb |
[Kr]4d105s25p3 | 103 |
Lr |
[Rn]5f146d17s2 |
52 |
Te |
[Kr]4d105s25p4 |
La configuración 2s22p6 del neón es un ejemplo de una capa cerrada o capa que se encuentra completamente llena de electrones. La configuración 1s22s22p6 se escribe como [Ne] para expresar los electrones internos de los elementos del tercer periodo. Así, la configuración electrónica del Na se obtiene añadiendo 1 electrón más a la configuración del Ne, resultando [Ne]3s1. El llenado de la capa 3 continua a lo largo del periodo hasta llegar al gas noble Ar cuya configuración electrónica [Ne]3s23p6 es también de capa cerrada y se escribe [Ar] para los expresar los electrones internos de los elementos del cuarto periodo (n = 4). En este periodo y a partir del Sc se comienza a llenar la subcapa 3d, comenzando el bloque d de elementos de la tabla periódica. Los datos espectroscópicos demuestran que la configuración electrónica de los elementos de la primera serie de transición d, en su estado fundamental, es del tipo 3dn4s2, con los orbitales 4s completamente ocupados a pesar de que los orbitales 3d, de menor energía, se encuentran vacíos parcialmente. Este hecho no está en desacuerdo con el orden de energía ya comentado en las Figuras 4 y 5. No hay que confundir el nivel energético de cada orbital por separado con la energía de un átomo con N electrones, en el que las repulsiones interelectrónicas son muy importantes. De hecho, dos electrones en un orbital d se repelen con mayor fuerza (y por ende suponen una desestabilización energética) que otros dos electrones en un orbital s.
En algunas ocasiones la configuración electrónica de un elemento difiere de la esperada siguiendo el principio de construcción. Estos casos son excepciones a dicho Principio, y se han resaltado en negrita en la Tabla 2. Ello es debido a que pueden darse ciertas distribuciones de electrones que supongan una disminución de energía. Por ejemplo, una configuración que suponga la existencia de una capa llena o semillena es favorable desde un punto de vista energético. Es el caso del Cr, que según el Principio de Construcción debería tener una configuración de 3d44s2 y sin embargo la configuración real es 3d54s1, ya que así se alcanza la configuración semillena en los orbitales 3d. Algo similar ocurre con el cobre, que presenta 3d104s1 en lugar de 3d94s2, pues así se alcanza la capa 3d llena.
En el caso de los elementos lantánidos (número atómico 58 al 71) e inmediatamente siguientes las energías de los orbitales 4f y 5d son muy similares, por lo que se producen numerosas excepciones debido a la insignificante diferencia de energía entre las configuraciones 5dn+14fm y 5dn4fm+1. En cualquier caso, la configuración "teórica" de los lantánidos sería 4fn5d16s2, lo que debido a la penetración de los orbitales 4f deja como electrones de la capa de valencia a los 5d16s2. Ello explica que el estado de oxidación más estable para estos elementos sea el +3.