Los gases ejercen presión sobre cualquier superficie con la que entren en contacto, ya que las moléculas gaseosas se hallan en constante movimiento. Al estar en movimiento continuo, las moléculas de un gas golpean frecuentemente las paredes internas del recipiente que los contiene. Al hacerlo, inmediatamente rebotan sin pérdida de energía cinética, pero el cambio de dirección (aceleración) aplica una fuerza a las paredes del recipiente. Esta fuerza, dividida por la superficie total sobre la que actúa, es la presión del gas.
Definición de presión: La presión se define como una fuerza aplicada por unidad de área, es decir, una fuerza dividida por el área sobre la que se distribuye la fuerza.
Presión = Fuerza / Área
La presión de un gas se observa mediante la medición de la presión externa que debe ser aplicada a fin de mantener un gas sin expansión ni contracción.
Para visualizarlo, imaginen un gas atrapado dentro de un cilindro que tiene un extremo cerrado por en el otro un pistón que se mueve libremente. Con el fin de mantener el gas en el recipiente, se debe colocar una cierta cantidad de peso en el pistón (más precisamente, una fuerza, f) a fin de equilibrar exactamente la fuerza ejercida por el gas en la parte inferior del pistón, y que tiende a empujarlo hacia arriba. La presión del gas es simplemente el cociente f / A, donde A es el área de sección transversal del pistón.
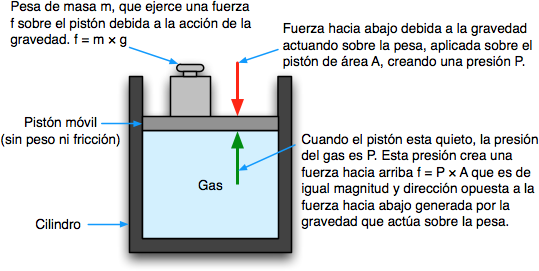
Unidades de presión
La presión es una de las propiedades de los gases que se mide con mayor facilidad. En unidades del sistema internacional (SI), la fuerza se expresa en newtons (N) y el área en metros cuadrados (m2). La correspondiente fuerza por unidad de área, la presión, está en en unidades de N/m.
La unidad del SI de presión es el pascal (Pa) que se define como una presión de un newton por metro cuadrado. De esta forma, una presión en pascales está dada por:
P(Pa) = F(N) / A (m2)
Como el pascal es una unidad de presión muy pequeña, en general las presiones son dadas en kilopascales (kPa).
Para llegar a las unidades de presión, primero se empieza con la velocidad y la aceleración (de las moléculas del gas).
La velocidad es la distancia recorrida en función del tiempo:
velocidad (m/s) = distancia recorrida (m)/ tiempo (s)
Luego tenemos la aceleración qye es el cambio de velocidad en función del tiempo:
aceleración (m/s2)= Velocidad inicial (m/s) - Velocidad final (m/s) / tiempo (t)
Luego tenemos la fuerza, que es el producto de la masa y la aceleración
fuerza (N) = masa (kg) x aceleración (m/s2)
y finalmente llegamos a la presión
Presión (Pa) = Fuerza (N) / Área (m2)
En química, es muy común encontrar las unidades de presión de los gases exporesadas en atmósferas (atm), milímetos de mercurio (mmHg), o torr.
101325 Pa = 1 atm = 760mmHg = 760 torr
El barómetro
Un barómetro es un instrumento que se utiliza para medir la presión ejercida por la atmósfera. Un barómetro sencillo consta en un tubo largo de vidrio, cerrado de un extremo y lleno de mercurio. Si el tubo se invierte con cuidado y lo colocamos verticalmente sobre un recipiente que contenga mercurio, de manera que no entre aire en el tubo. El nivel del mercurio en el tubo desciende hasta una altura determinada y se mantiene en ese nivel creando un vacío en el extremo superior.
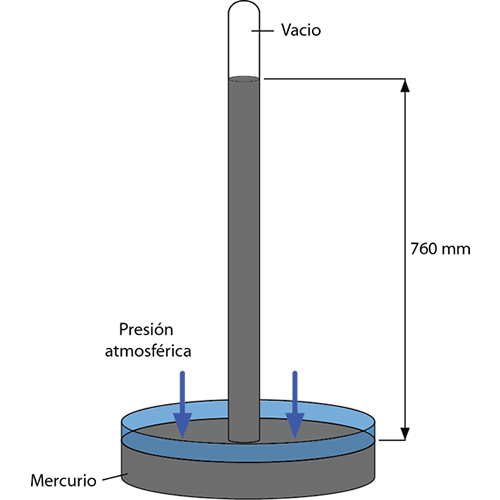
Si se coloca un tubo abierto en forma vertical con uno de sus dos extremos en un recipiente con mercurio, los niveles del mercurio dentro y fuera del tubo coinciden, pero en el tubo cerrado del barómetro algo mantiene al mercurio a una altura mayor dentro del tubo que fuera en el recipiente. Dentro del tubo con el extremo cerrado, no hay aire por encima del mercurio (sólo trazas de vapor de mercurio). La atmósfera ejerce una fuerza sobre la superficie del mercurio en la parte exterior del recipiente que se transmite a través del líquido, haciendo que suba una columna de mercurio. Esta columna ejerce una presión hacia abajo que depende de su altura y de la densidad del mercurio líquido. Para una cierta altura, se igualan la presión en la base de la columna de mercurio y la de la atmósfera. De esta forma, la columna se mantiene.
La altura del mercurio en un barómetro se llama presión barométrica, y varía con las condiciones atmosféricas y con la altitud en la que se realiza la medición. La presión atmosférica estándar (atm) se define como la presión que ejerce una columna de mercurio con una altura de exactamente 760 mm a 0ºC al nivel de mar, cuando la densidad del mercurio es = 13,5951 g/cm3 y la aceleración de la gravedad es exactamente g = 9,80665 ms2. Esta definición establece una relación entre dos unidades de presión muy útiles, la atmósfera estándar (atm) y el milímetro de mercurio (mmHg). La unidad mmHG también es llamada torr en honor al científico italiano Evangelista Torricelli, quien inventó el barómetro.
El manómetro
Un manómetro es un dispositivo para medir la presión de gases distintos a los de la atmósfera. El barómetro de mercurio es indispensable para medir la presión de la atmósfera, pero rara vez podemos utilizarlo como único instrumento para medir las presiones de otros gases. La dificultad reside en la colocación del barómetro dentro del recipiente del gas cuya presión deseamos medir. Sun embargo podemos comparar la presión del gas y la presión barométrica con un manómetro
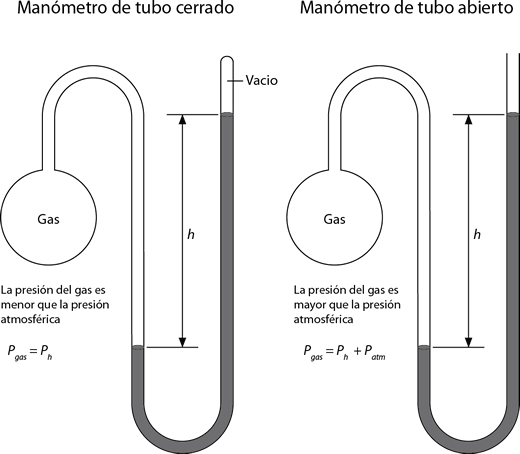
El principio de operación de un amnómetro es parecido al de un barómetro. Existen dos tipos de manómetros: El manómetro de tubo o rama cerrada y el manómetro de tubo o rama abierta. El manómetro de tubo cerrado se utiliza comúnmente para medir presiones menores a la presión atmosférica, mientras que el manómetro de tubo abierto es más adecuado para medir presiones iguales o mayores que la presión atmosférica.
En un manómetro de rama abierta. Siempre que la presión del gas que se está midiendo y la presión atmosférica (barométrica) sean iguales, las alturas de las columnas del mercurio en las dos ramas del manómetro serán iguales. La diferencia de alturas de las dos ramas implica una diferencia entre la presión del gas y la presión barométrica.
Casi todos los barómetros y la mayoría de los manómetros emplean mercurio como fluido de trabajo, a pesar de que es una sustancia tóxica, al igual que sus vapores. La razón es que el mercurio tiene una densidad muy alta (13.6g/mL) en comparación con la mayoría de los líquidos. Como la altura de la columna de un líquido es inversamente proporcional a su densidad, esta propiedad permite construir barómetros y manómetros pequeños que se manipulan con facilidad.