El término acero nombra a una familia muy numerosa de aleaciones metálicas en base al aleado del Fe (hierro) y el C (carbono).
La economía y el desarrollo tecnológico de un país se ha medido con frecuencia en relación al volumen de producción y consumo de acero.
Este aleado del acero se hace con el propósito de mejorar las propiedades del metal puro, cuya dureza y tenacidad son funciones de la concentración de C.
El C no es único elemento de aleación con el Fe, sino que pueden intervenir diversos elementos metálicos y no metálicos. Los elementos aleantes permiten:
- el control de otras propiedades, como la resistencia a la tracción, la dureza, la resistencia a la corrosión
- el endurecimiento por templado
- el refinamiento de la micro estructura (tamaño de grano, de carburos, fases secundarias, etc.), entre algunos características tecnológicas exigidas por cada aplicación específica.
El Hierro
El hierro es el elemento metálico de mayor uso en el mundo; sin embargo, no se le utiliza químicamente puro sino aleado con el carbono para obtener el acero.
El mineral de hierro se encuentra en diversas formas (tabla 1):
Tabla 1: Minerales de hierro
Mineral |
Composición |
|---|---|
Hematita |
Fe2O3 |
Limonita |
Fe2O3H2O |
Magnetita |
Fe3O4 |
Siderita |
FeCO3 |
Pirita |
FeS2 |
Cromita |
FeOCr2O3 |
El hierro es un metal, relativamente duro y tenaz, con diámetro atómico dA = 24,8 nm (1 nm = 10-9 n = 0.001 mm), con temperatura de fusión de 1535 ºC y punto de ebullición 2740 ºC.
El Fe tiene el número atómico Z = 26 (26 protones) y su peso atómico es 56 g/mol (26 protones y 30 neutrones) (Figura 1).
Esos electrones se distribuyen de acuerdo a la configuración:
1 s2 2 s2 2 p2 3 s2 3 p6 3 d10 4 s2
Tabla 2: Distribución de electrones en los orbitales atómicos del Fe
n nivel de energía |
||||
|---|---|---|---|---|
orbital |
1 |
2 |
3 |
4 |
s |
2 |
2 |
2 |
2 |
p |
----- |
6 |
6 |
----- |
d |
----- |
----- |
10 |
----- |
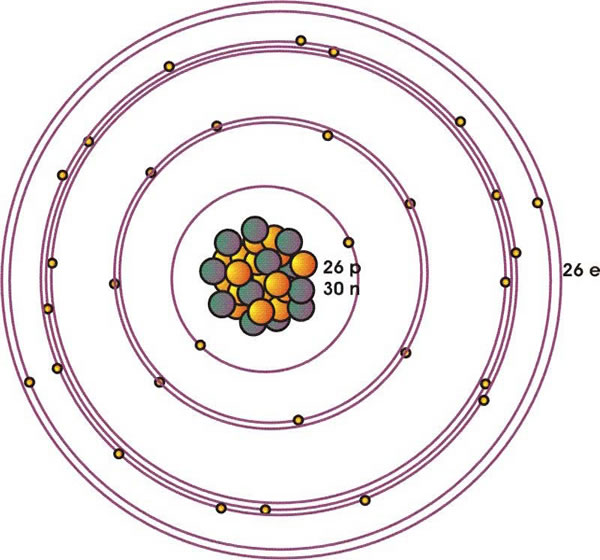
Figura 1: Esquema de la estructura atómica del Fe, compuesta por 26 protones y 30 neutrones del núcleo y 26 electrones distribuidos en 4 niveles de energía principales (n=1,..4). Cada circulo representa un orbital ocupado por electrones, que en esta estructura involucra a los de tipo s (l = 0, m=0), p (l=1, m=-1, 0, 1) y d (l= 2, m=-2, -1, 0, 1, 2).
El Fe presenta distintas formas alotrópicas (diversas formas cristalinas), b.c.c. y f.c.c. (Figura 2).
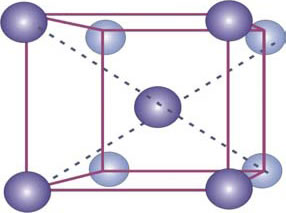
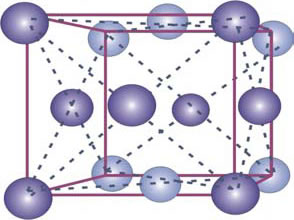
Figura 2: Estructuras cristalinas de las distintas formas alotrópicas del Fe. Fe α de celda cristalina b.c.c. (arriba) y Fe γ de celda f.c.c. (abajo).
El Fe pasa de una estructura b.c.c., conocida como hierro alfa, que existe desde temperatura ambiente hasta los 910 oC, a una estructura f.c.c. del hierro gamma, que existe entre los 912 y 1500oC, y luego retorna a la estructura b.c.c., esta vez, del hierro delta, que existe hasta los 1540oC (Tabla 3).
Tabla 3: Formas alotrópicas del hierro
Forma |
Estructura |
Temperatura [ºC] |
|---|---|---|
| Hierro alfa | b.c.c. |
< 912 |
| Hierro gamma | f.c.c. |
912-1500 |
| Hierro delta | b.c.c. |
1500-1540 |
El Carbono
El carbono es un metaloide, con diámetro mucho más pequeño (dA = 15,4 nm) que el Fe. Es blando y frágil en la mayoría de sus formas alotrópicas (excepto en la forma de diamante en que su estructura cristalográfica lo hace el más duro de los materiales conocidos). Es la diferencia en diámetros atómicos lo que va a permitir al elemento de átomo más pequeño difundir a través de la celda del otro elemento de mayor diámetro.
El C tiene el número atómico Z = 6 (6 protones) y su peso atómico es 56 g/mol (6 protones y 6 neutrones) (Figura 3).
Los 6 electrones se distribuyen en 2 niveles de energía principales (Tabla 4) según la configuración:
1 s2 2 s2 2 p2
Tabla 4: Distribución de electrones en el carbono
n nivel de energía orbital |
||
|---|---|---|
orbital |
1 |
2 |
s |
2 |
2 |
p |
----- |
2 |
El C puede cristalizar en diversas formas que dependen variables de temperatura, tiempo y presión puestas en juego en la naturaleza o en los procesos de síntesis (Figura 6).
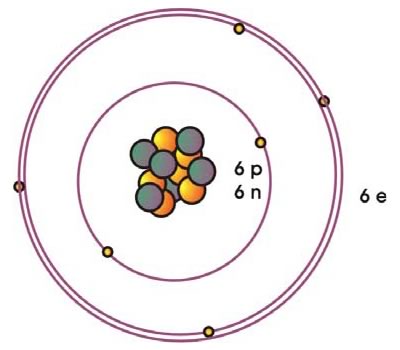
Figura 3: Esquema de la estructura atómica del carbono, compuesta por 6 protones y 6 neutrones del núcleo y 6 electrones distribuidos en 2 niveles de energía principales (n=1,2). Cada circulo representa un orbital ocupado por electrones, que involucra a los de tipo s (l = 0, m=0), p (l=1, m=-1 y 1).
Una de las formas alotrópicas es denominada grafito y está caracterizada por capas atómicas constituidas por átomos unidos en hexágonos. A su vez, cada capa se enlaza con otra vecina por medio de un enlace químico más débil que el presente en una capa, de modo que los deslizamientos entre capas pueden producirse empleando muy poca energía. Esta característica determinar las buenas propiedades lubricantes de grafito. A pesar, que esta forma alotrópica del C tiene una conductividad eléctrica comparable con metálica, la mayor parte de sus propiedades (falta de plasticidad, baja reflectividad, etc.) corresponden a la de un metaloide, integrando el grupo del Si y el Ge. Sin embargo, las propiedades mecánicas del C se potencian notablemente cuando asume la estructura del diamante de estos dos elementos. Esta estructura es el resultado de conjunción de altas temperaturas y presiones aplicadas al grafito que incrementando el número de átomo por celda a 8. Los enlaces químicos con que están ligados los átomos, denominados enlaces covalentes, se caracterizan por compartir con los carbonos vecinos los 4 electrones de la capa más externa, la capa de valencia. Este enlace "cooperativo" permite completar esta capa con 8 electrones, condición estabilidad química.
Existen diversos procesos químicos que permiten la síntesis de estructuras con geometría de celdas cristalinas mucho más complejas a las descriptas (esféricas, tubulares, etc.), denominados fulerenos, y que permiten aglutinar decenas de átomos (Figura 5).
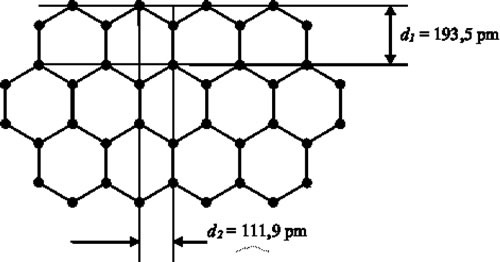
Figura 5: Estructura hexagonal de una capa atómica grafito que se enlaza débilmente con las otras capas vecinas.
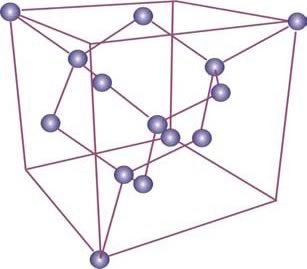
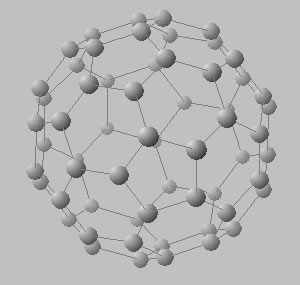
Estructuras cristalinas de las distintas formas alotrópicas del C. Estructura del diamante (en arriba) con 8 átomos de C por celda. Estructura típica de un fulereno cuya celda puede estar constituía por un número muy grande de átomos (60 100 o más) (en el medio y abajo).
Naturaleza química y física del acero
La comparación de las propiedades físico- químicas del Fe y C pone en evidencia sus marcadas diferencias (Tabla 5).
Tabla 5: Algunas propiedades físicas del carbono y del hierro.
Hierro |
Carbono |
|
|---|---|---|
Expansión térmica lineal [x 10-6 mm/mm/ºC] |
11,76 |
0,6- 4,3 |
Conductividad térmica [cal/cm2/cm/seg/ºC] |
0,18 |
0,057 |
Resistividad eléctrica [x 10-6 ohms-cm] |
9,71 ( 25 ºC) |
1375 (0 ºC) |
Módulo de elasticidad [x106 kg/mm2] |
0,5 |
20,1 |
Naturaleza elemento |
Metal |
Metaloide |
El carbono constituye el soluto de la solución sólida del C en Fe. Allí, el átomo de carbono se aloja en los intersticios (espacios entre los átomos) del ordenamiento b.c.c. o f.c.c. del Fe, debido a que el radio atómico del C (15,4 nm) es menor al del Fe (24,8 nm) (Figura 6).
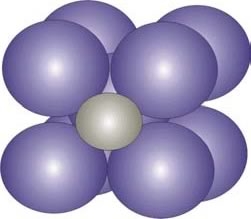
Figura 6: Carbono intersticial (átomo más pequeño) en la solución sólida intersticial de C en Fe b.c.c.
Algo análogo ocurre con los elementos gaseosos, de diámetro atómico menor a 20 nm, los que tienen una probabilidad elevada de difundir a través de los intersticios de la estructura cristalina del hierro (Tabla 6).
Tabla 6: Elementos intersticiales en la estructura del Fe
Elemento |
diámetro atómico [nm] |
|---|---|
B |
19.4 |
C |
15,4 |
N |
14,2 |
O |
12 |
H |
9,2 |
La difusión intersticial es responsable de una gran cantidad de posibilidades tecnológicas y variantes de las propiedades del acero (Fig. 7).
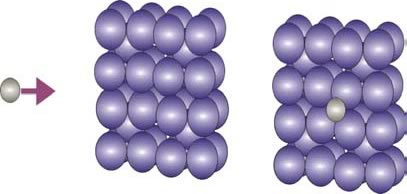
Figura 7: Proceso de difusión intersticial en la estructura b.c.c. del Fe.
El aprovechamiento de este fenómeno permitirá el endurecimiento del acero por medio de la formación de la solución sólida intersticial de carbono en hierro. Además, la formación de compuestos intersticiales como los carburos y los nitruros constituyen los componentes muy duros en los aceros aleados.
Otros elementos como el cromo, níquel, titanio, manganeso, vanadio, cobre, etc., con diámetros atómicos cercanos al del hierro, forman soluciones sólidas substitucionales con el Fe al reemplazarlo en la estructura cristalina (Figura 8). Este fenómeno depende del rango de diámetros atómicos, la semejanza de estructura cristalina, la afinidad química y las valencias relativas de los elementos.
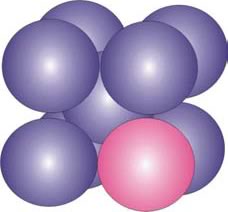
Figura 8: Elemento metálico (esfera de color claro) en la soluciones sólida substitucional con el Fe b.c.c.
La fase alfa y la fase delta del acero cristalizan con una estructura tipo b.c.c. con parámetros de red iguales, formando un cubo perfecto. Aquí, un átomo completo se coloca en el centro del cubo y ocho átomos se ubican en las esquinas (Fig. 2). En términos totales hay 2 átomos por cada cubo o celda unitaria:
8 átomos en las esquinas x 1/8 = 1 átomo
1 átomo central = 1 átomo
Total = 2 átomos
La fase gamma cristaliza en el sistema f.c.c. con 6 átomos se ubican en las caras de la celda o cubo y 8 átomos en las esquinas (Fig. 7-2). La celda unitaria tiene 4 átomos pues:
8 átomos en las esquinas x 1/8 = 1 átomo
6 átomos centrados en las caras x 1⁄2 = 3 átomo
Total = 4 átomos
6 átomos centrados en las caras x 1⁄2 = 3 átomo
Total = 4 átomos
Estos resultados demuestran que la estructura f.c.c. es más densa que la b.c.c.
Los átomos en cada uno de esos ordenamientos tienen factores de empaquetamiento, o espacio ocupado por los átomos en la celda unitaria, expresado en fracción unitaria, distintos. La celda f.c.c. este factor es 0,74, mientras que para la b.c.c. es 0,68. Así resulta, que los intersticios de la celda f.c.c. ocupan el 26 % del volumen, mientras en la celda b.c.c. ocupan el 32 %.
Las fases distintas del hierro incorporan fundamentalmente a los átomos de carbono, y en menor cantidad, a otros elementos, originando una familia enorme de aleaciones conocida como acero. La diferencia de las fases presentes en aceros diferentes se debe a sus composiciones diferentes.
Las propiedades mecánicas en los aceros son afectadas notoriamente por el contenido de carbono (Figura 9), que determina contenidos diferentes de de los componentes más duros en el acero, como la cementita, o de su mezcla eutectoide, la perlita. Aún en estado de temple (endurecido por enfriamiento rápido), el contenido de carbono del acero sigue siendo importante, pues una martensita de mayor contenido de carbono será también más dura.
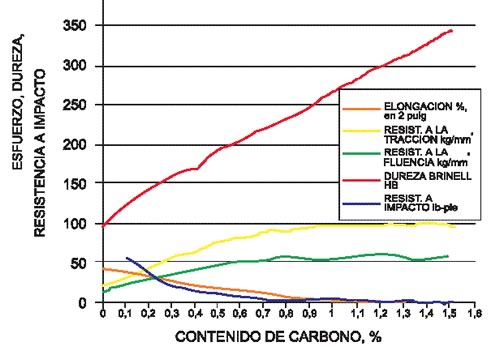
Figura 9: Propiedades mecánicas del acero en función de la concentración de carbono.
Naturaleza micro estructural del acero
Los granos de un acero pueden estar constituidos por una o más fases del tipo: austenita, ferrita, perlita, cementita. Así, por ejemplo, un acero al carbono, con una concentración de C de 0,20 %, estará formado por 75% de ferrita (< 0,008 % C) y aprox. 25 % de perlita (con 0,8 % C); mientras un acero de mayor una concentración de C (por Ej., 0,40 %) tendrá mayor proporción de perlita (aproximadamente 50 %).
Micro estructuras del acero
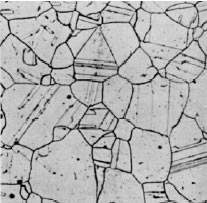
a. Austenita (acero inoxidable)
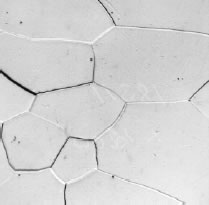
b. Ferrita (< 0.02 C, % en peso)
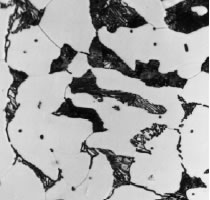
c. Ferrita + Perlita (0.3 C % en peso)

d. Ferrita + Perlita (0.6 C % en peso)

e. Perlita (0.85 C % en peso)

f. Perlita + cementita ínter granular
Los aceros del primer tipo son las barras cuadradas y los ángulos, mientras las barras corrugadas son de acero del segundo tipo.
Cada fase tiene diferente estructura cristalina o cristalográfica, y, por tanto, cada fase posee diferentes propiedades. El acero tiene propiedades que varían con la proporción de las fases presentes en su micro estructura, y cuya magnitud es proporcional al promedio de "pesado" del conjunto de fases (producto del contenido de la fase y la magnitud de la propiedad).
En los aceros aleados, aparecerán otras fases, como carburos, nitruros, boruros, óxidos, etc. que mejoran o degradan ciertas propiedades. Además, el proceso de manufactura del acero puede introducir otras fases, que son conocidas como inclusiones: compuestos químicos asociados a óxidos, silicatos, aluminatos, boruros, nitruros, etc., que contaminan el acero y cuya presencia se trata de evitar o minimizar durante su fabricación. Por otra parte, existen inclusiones de sulfuro de manganeso y sulfuro de hierro que mejoran la maquinabilidad del acero.
Diagramas de fases.
La forma más simple de representar la presencia de las distintas fases del acero y el efecto del contenido de C sobre ellas es el diagrama de fases en equilibrio hierro-carbono (Figura 10).
Parte de este diagrama hierro-carbono tiene interés tecnológico y es la zona muy próxima al 100 % de Fe. Por este motivo, se suele trabajar con el diagrama de Fe y Carburo de Fe.
El carburo de hierro conocido como cementita es Fe3C (6,67% C) (Figura 7-13). Este diagrama es metaestable, pues se considera a la cementita como una fase cuasi estable y técnicamente representa condiciones de equilibrio útiles para describir las transformaciones de fase en los aceros.
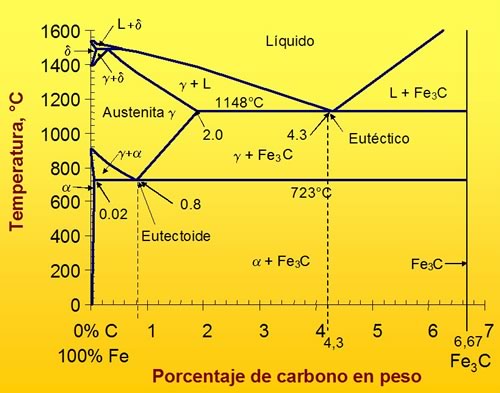
Figura 10: Diagrama de Fases Metaestable del Fe y Carburo de Hierro.
El contenido de carbono permite dividir ese diagrama en dos partes:
- los aceros (0 -2 % C).
- las fundiciones (2 - 6,67 % C).
En el diagrama existen varias soluciones sólidas. La solución sólida gamma (derivada de la fase gamma del hierro) es conocida como austenita con una estructura f.c.c. A alta temperatura existe una región de la solución sólida delta (derivada de la fase delta del hierro) con estructura b.c.c. Mientras que a menor temperatura existe la región de la solución sólida ferrita (derivada de la fase alfa del hierro) también con estructura b.c.c. La transformación más importante, desde el punto de vista de aplicación técnica, es la transformación austenítica (Figura 11):
Austenita ( γ ) → Ferrita ( a ) + Cementita (

Figura 11: Transformación austenítica a la temperatura eutectoide (723 ºC) que conduce a conversión de los granos austeníticos (a la derecha) la formación de granos de Ferrita ( a ) (gris claros) y segregación ínter granular de carburo de Fe Cementita (CFe3) (zonas en negro).
Esta transformación ocurre a 723 ºC, que es conocida a la temperatura eutectoide (Figura 10), y su control es una herramienta potente para establecer las propiedades mecánicas del acero, de acuerdo a su aplicación.
Los tratamientos térmicos son el medio para el control y aprovechamiento de esa transformación La velocidad de enfriamiento determina la micro estructura final del acero, definiendo si la fases presentes son meta estables o estables o si están fuera del equilibrio. Esta velocidad determina las propiedades mecánicas, físicas, químicas, etc. asociadas con las fases presentes.
La transformación eutectoide realizada por enfriamiento lento produce la mezcla eutectoide llamada perlita, formada por finas capas alternadas de cementita y ferrita.
Efecto de la velocidad de enfriamiento
El espesor de las capas y el tamaño de grano del acero crece en forma inversa a la velocidad de enfriamiento. El tratamiento térmico conocido como recocido permite este efecto, mientras que aumento de la velocidad de enfriamiento permite obtener una perlita con capas o lamelas más finas, como sucede en el normalizado. El acero recocido es más blando que el acero normalizado.
Un enfriamiento muy rápido desde la zona austenítica, que evita la transformación eutectoide, conduce a una fase fuera del equilibrio llamada martensita. Este micro estructura tiene dureza elevada y cierta fragilidad. La martensita es una solución sólida sobresaturada de carbono atrapado en hierro alfa lo que lleva a una estructura b.c.t. (body centered tethragonal o tetragonal de cuerpo centrado) derivada de la estructura b.c.c. El eje z de la celda cúbica es mayor debido a la inclusión de átomos de carbono (Figura 12).
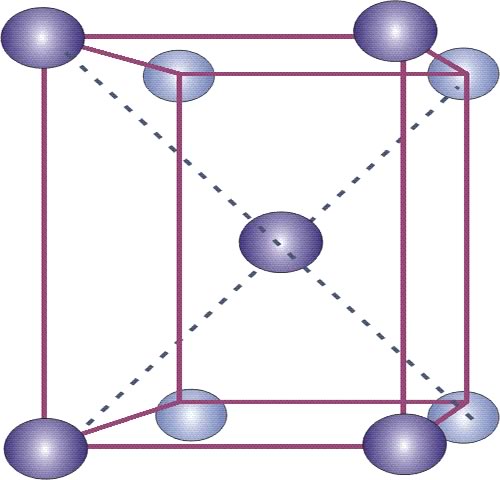
Figura 12: Estructura cristalina de la martensita b.c.t. (body centered tethragonal o tetragonal de cuerpo centrado).
Esta fuerte alteración de la red es la responsable de la alta dureza de la martensita y también de su aspecto micro estructural acicular (Figura 13).
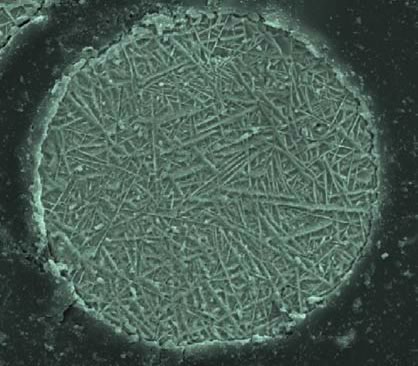
Figura 13: micro estructura martensítica en partículas de acero de 119 μm enfriada muy rápidamente.
Los temples o enfriamientos en aceite y salmuera son la forma para obtener la micro estructura martensítica.