Introducción
¿Cómo se da olor a lo inodoro?, ¿Cuáles son las particularidades de estos compuestos?, ¿Cuál es el real olor del gas licuado?.
Estas eternas preguntas que parecen de niños, son realmente importantes si lo que se quiere analizar son las particularidades de los gases altamente combustibles y encontrar con esto un compuesto que ayuda a la vida moderna casi desde el anonimato y que además es ocupado en otros procesos productivos de gran importancia para la economía nacional y el futuro de las comunicaciones.
Estos productos también tienen un uso farmacológico importante.
A lo largo de estas paginas se dará respuesta a estas interrogantes, de forma clara y concreta para así agradecer a los mercaptanos su aporte al desarrollo del país y a la manutención de la vida de las personas.
El Azufre
Estado Natural del Azufre
Es un elemento muy abundante en la naturaleza; se encuentra tanto en estado libre como combinado. En estado natural se halla en las zonas volcánicas; combinado se encuentra formando sulfuros, como la pirita (FeS2), la glena (PbS), la blenda (ZnS), cinabrio (HgS), la calcosina (Cu2S) y también formando sulfatos como la biritina (BaSO4), el yeso (BaSO4.2H2O), etc. ; también se encuentra en el petróleo.
Obtención
El azufre se obtiene por medio del procedimiento frasch, extrayéndolo de los mismos yacimientos. Este procedimiento consiste en introducir en el terreno tres tubos concéntricos hasta alcanzar el yacimiento de azufre. Por el tubo exterior se inyecta agua sobrecalentada en las capas de azufre para fundirlo. Por el tubo interior se bombea aire comprimido. Al fundirse el azufre es extraído por el tubo intermedio mediante aire comprimido, en forma de emulsión.
Propiedades y Alatropía
El azufre es un sólido amarillo que está presente en varios estados alotrópicos. El azufre rómbico es estable a temperatura ordinaria e insoluble en agua, pero, soluble en muchos disolventes orgánicos: sus átomos se enlazan formando un octaedro. El azufre rómbico al sobrepasar la temperatura de 95,5ºC se convierte en azufre monoclínico. Cuando este se calienta a más de 119ºC, el azufre se funde formando un liquido de color amarillo. A medida que se aumenta la temperatura se va volviendo más viscoso y oscuro, además si se vierte agua, se forma el azufre amorfo o plástico.
El azufre es químicamente poco reactivo, pero en condiciones adecuadas se combina con casi todos los elementos.
Aplicaciones
El azufre tiene numerosas aplicaciones: vulcanización de caucho; antiparásito en la agricultura, combate el oidium de la vid; se utiliza para combatir enfermedades de la piel; como aislante eléctrico, para las fabricaciones de pólvoras y fulminantes, en la obtención de ácido y trióxido de azufre, etc.
Compuestos Orgánicos del Azufre
Tioles y Sulfuros: Muchos compuestos orgánicos con oxigeno tienen análogos con azufre. El análogo de un alcohol se llama alcanotiol, sencillamente Tiol, o su nombre más antiguo, mercaptanos. El grupo –SH se llama grupo tiol o grupo sulfihidrido.
CH3SH
Metanotiol
CH3CH2CH(SH)CH3
2-Butanotiol
La propiedad más característica de un tiol es su olor, La raza humana es muy sensible a estos compuestos pudiendo detectar su presencia a niveles 0,02 partes de tiol en mil millones de partes de aire. El olor de los zorrillos se debe, principalmente, a algunos tioles sencillos.
Podemos deducir algunas propiedades de los tioles en relación con la de los alcoholes, comparando el sulfuro de hidrogeno y el agua, por ejemplo:
H2S (pKq = 7,04) es un ácido más fuerte que el H2O (pKq = 15,7)
Los tioles (pKq ~8), también son ácidos substancialmente más fuerte que los alcoholes (pKq = ~16)
CH3CH2SH |
+ |
OH |
CH3CH2S + H2O |
|
Ácido más fuerte que el agua |
Base más fuerte (RS) |
El azufre es menos electronegativo que el oxigeno, sus electrones externos están mas esparcidos por consiguiente los átomos de azufre forman enlaces de hidrogeno más débiles que los átomos de oxigeno. Por esta razón el H2S (p. eb. –61ºC) es más volátil que el H2O (p. eb. 100ºC) y los tioles son más volátiles que sus alcoholes análogos. El tratamiento de un halogenuro de alquilo con ion sulfuro ácido (HS-), da lugar a un tiol, se logra buen rendimiento solo si se emplea un exceso de sulfuro ácido inorgánico, porque el tiol resultante (que es ácido) puede ionizarce para formar el ion RS- que también es un buen nucleofero y la reacción de Rs- con el dihalogenuro de alquilo da un sulfuro R2S.
CH3I + SH- |
CH3SH + I- |
|
metanotiol |
H+ |
CH3I |
|||
CH3SH |
CH3S- |
CH3SCH3 |
||
Sulfuro de dimetilo |
Cuando un tiol se trata con oxidantes suaves (tales como I2) sufre una reacción de acoplamiento para formar un disulfuro, compuesto que tiene enlace S-S.
Esta reacción puede invertirse, tratando el disulfuro con un reductor (tal como el litio metálico en NH3 liquido).
[O] |
||
2CH3CH2SH |
CH3CH2S-SCH2CH3 |
|
[H] |
Disulfuro de dietilo |
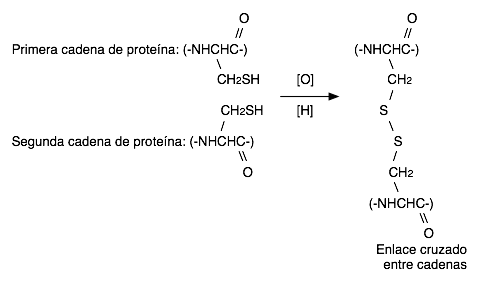
Este enlace disulfuro es una característica fundamental en algunas proteínas, la unión disulfuro ayuda a mantener las cadenas de proteínas unidas en forma apropiada.
La posición del disulfuro determina si el cabello es rizado o lacio.
La cadena lateral del tiol de la cisteina desempeña un rol único en la estructura de las proteínas.
Los tioles pueden sufrir un acoplamiento oxidativo, para dar disulfuros, este acoplamiento de dos unidades de cisteina da un nuevo aminoácido llamado cistina y proporciona un medio de unir transversalmente las cadenas de proteínas. El dar al pelo una ondulación permanente implica ruptura de algunos enlaces S-S en otras posiciones de la cadena de proteínas.
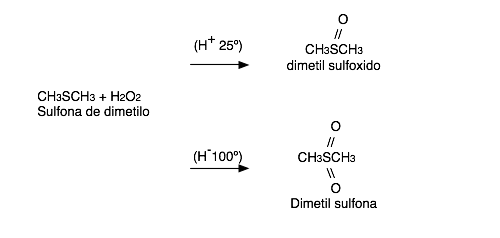
El Sulfuro puede oxidarse a sulfoxido o sulfona, dependiendo de las condiciones de reacción. Por ejemplo el peróxido de hidrogeno al 30% en presencia de un ácido oxida un sulfuro a sulfoxido a 25 ºC y sulfura a 100ºC.
El dimetil sulfoxido (DMSO) se prepara industrialmente por oxidación de aire de sulfuro de dimetilo, también es un subproducto de la industria del papel. El DMSO es un disolvente único versátil tiene una constante dieléctrica alta (491), pero no forma enlace de hidrogeno en estado puro. Es un disolvente poderoso para iones inorgánicos y compuestos orgánicos. Los reactivos con frecuencia realizan su reactividad en DMSO al compararlo con la que realizan en disolventes alcohólicos.
El DMSO penetra fácilmente la piel y sé a usado para promover la absorción epidérmica de fármacos; sin embargo, el DMSO puede causar la absorción de suciedad y veneno. Algo común en los que trabajan con DMSO es cuando les salpica en las manos, pueden percibir su olor.