Introducción
La serie de lantánidos es el grupo de elementos químicos que siguen al lantano en el grupo IIIB de la tabla periódica. Su distinción atómica es que ocupan en subnivel electrónico 4f. En un principio, sólo estos elementos con números atómicos 58 a 71 son lantánidos.
Ellos son los siguientes:
| Cerio (Ce58) | Europio (Eu 63) | Erbio Er 68) |
| Praseodimio (Pr 59) | Gadolinio (Gd 64) | Tulio (Tm 69) |
| Neodimio (Nd 60) | Terbio (Tb 65) | Iterbio (Yb 70) |
| Prometio (Pm 61) | Disprosio (Dy 66) | Lutecio (Lu 71) |
| Samario (Sm 62) | Holmio (67 Ho) |
Muchos químicos incluyen al lantano (La 57) en la serie, ya que tiene propiedades similares a los lantánidos, pero no completa el subnivel 4f.
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Período | |||||||||||||||||||
| 1 | 1 H |
2 He |
|||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
|||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
|||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
|
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
|
| 6 | 55 Cs |
56 Ba |
* | 71 Lu |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
| 7 | 87 Fr |
88 Ra |
** | 103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Uub |
113 Uut |
114 Uuq |
115 Uup |
116 Uuh |
117 Uus |
118 Uuo |
| *Lantánidos | * | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
||||
| **Actínidos | ** | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
||||
Los elementos del grupo IIIB, incluyendo al escandio (Sc 21) y al Itrio (Y 39), son también conocidos como tierras raras, porque fueron originalmente descubiertas juntas en minerales raros e insolados como óxidos, o "tierras". En comparación con muchos otros elementos, las tierras raras no son realmente "raras", a excepción del prometio, que sólo tiene isótopos radioactivos.
Los lantánidos se encuentran en muchos minerales, principalmente en la MONAZITA. En rocas ígneas sobre la superficie de la tierra, el cerio es el elemento más abundante de ellos. Los lantánidos puros son metales plateados con altos puntos de ebullición. Reaccionan lentamente con el aire, excepto el Samario, el Europio, y el Iterbio, que son mucho mas reactivos con el oxígeno. Los metales son preparados de floruros u óxidos por un tratamiento con un fuerte reductor de metales, como el Calcio, o de sales cloruras y floruras por electrólisis a altas temperaturas. Los lantánidos son típicamente insolados en grupo precipitando sus hidróxidos insolubles, oxalatos o fosfatos. Luego, ellos son separados por un intercambio de iones -CROMATOGRAFÍA.
En un tiempo, el único uso comercial de las tierras raras era como mezcla de metal, uno de ellos consistía principalmente de cerio, lantano, y neodimio. Este es pirofosfórico (atrapan fuego en aire) cuando finalmente se dividió y es usado para hacer encendedores. La producción comercial de estas tierras raras hoy está creciendo. Ellos son usadas en metalurgia (para remover el azufre y el oxígeno) y para ser fuertes magnetos permanentes como es el SmCo (s). Otros usos son como fósforos en las pantallas de televisión; como catalizadores que descomponen los aires autocontaminantes.
Generalidades:
Los lantánidos (o lantanoides, como a veces se les llama), estrictamente hablando, son los catorce elementos que siguen al lantano en la tabla periódica, y en la cual, los catorce electrones 4f se añaden sucesivamente a la configuración del lantano.
Como estos electrones 4f intervienen relativamente poco en los enlaces, resulta que estos elementos altamente electropositivos tienen el ion M3+ como su estado de oxidación principal. El radio de este ión disminuye con el aumento de Z a partir del lantano, esto constituye la denominada “Contracción Lantánida”.
Puesto que el término “Lantánido” se usa para indicar que estos elementos forman un grupo estrechamente relacionado, para cuya química el Lantano es el prototipo, generalmente se toma el vocablo incluyendo el propio Lantano. No se conocen con toda certeza las configuraciones electrónicas debido a la gran complejidad de los espectros electrónicos de los átomos e iones y a la consecuente dificultad de análisis.
Los elementos Itrio y Escandio que se encuentran por encima del lantano en el grupo III de transición, poseen características similares a los lantánidos, y se los encuentra generalmente juntos en la naturaleza.
El término “Contracción Lantánida” se empleó al hablar de los elementos de la tercera serie de transición, ya que tiene ciertos efectos importantes sobre sus propiedades. Consta de una significativa y uniforme disminución en el tamaño de los átomos e iones con el aumento del número atómico; es decir, el Lantano tiene el mayor y el Lutecio el menor radio.
Esta contracción tiene la misma causa que las contracciones menos espectaculares que tienen lugar en la serie de transición en el bloque d, o sea, el poco efecto pantalla de un electrón hacia otro en la misma subcapa. A medida que se avanza del Lantano al Lutecio, la carga nuclear y el número de electrones 4f se incrementa en uno en cada etapa. El efecto de pantalla de un electrón 4f por otro es muy poco efectivo, debido a la forma de los orbitales f, de tal manera que a cada aumento, la carga nuclear efectiva experimentada por cada electrón 4f aumenta, por lo que se produce una reducción de tamaño en toda la capa 4fn. La acumulación de estas contracciones sucesivas constituye la contracción Lantánida.
Propiedades Magnéticas y espectrales:
Varios de los aspectos del comportamiento magnético y espectral de los lantánidos difieren fundamentalmente de los del bloque d correspondiente a los elementos de transición. La razón básica de estas diferencias reside en que los electrones que son responsables de las propiedades de los iones lantánidos son electrones 4f, y que los orbitales 4f están protegidos muy efectivamente de la influencia de fuerzas externas en las capas externas 5s2 y 5p6 . Es por ello que los estados que se originan desde las diversas configuraciones 4fn sólo son ligeramente afectados por el medio que rodea a los iones y permanecen prácticamente invariables para determinado ión en todos sus compuestos.
Las constantes de acoplamiento de spin -órbita son bastante grandes. Esto tiene por consecuencia que, salvo unas cuantas excepciones, los iones lantánidos posean estados fundamentales con un sólo y bien definido valor del momento angular total J, con el siguiente estado inferior de J, y con energías muchas veces mayores que el valor de KT, y por consiguiente el estado superior está virtualmente no poblado.
Los colores y estados electrónicos fundamentales de los iones M3+ se dan en la tabla que se encuentra a continuación; la consecuencia de los colores en la serie del lantano al Gadolinio se repiten accidentalmente en la serie del Lutecio al Gadolinio. Como ha quedado implícito en las explicaciones anteriores, los colores se deben a transiciones f-f , las cuales están virtualmente independientes del entorno exterior de iones.
| Ion |
Estado fundamental |
Color |
Ion |
Estado fundamental |
|---|---|---|---|---|
| La |
1S0 |
Incoloro |
Lu |
1S0 |
| Ce |
2F5/2 |
Incoloro |
Yb |
2F7/2 |
| Pr |
3H4 |
Verde |
Tm |
3H6 |
| Nd |
4I9/2 |
Lila |
Er |
4I15/2 |
| Pm |
5I4 |
Rosa; Amarillo |
Ho |
5I8 |
| Sm |
6H5/2 |
Amarillo |
Dy |
6H15/2 |
| Eu |
7F0 |
Rosa pálido |
Tb |
7F6 |
| Gd |
3S7/2 |
Incoloro |
Gd |
3S7/2 |
Una importante característica del comportamiento espectroscopio, es la fluorescencia o luminiscencia de ciertos iones lantánidos, en especial los de europio, cuando se usan como activadores en las redes cristalinas de los óxidos lantánidos, silicatos u óxidos de los metales de transición.
El isótopo 151Eu proporciona espectros de Mössbauer. Debido a éstas y otras características tales como largo tiempo de relajación del Gadolinio y del Europio en la resonancia del spin electrón, y a las propiedades fluorescentes de los iones lantánidos, se pueden usar como sondas por sistemas biológicas.
Estado natural y separación:
Los elementos lantánidos se conocían originalmente como las tierras raras debido a su presencia en las mezclas de oxidos. No son elementos raros y su abundancia absoluta en la litosfera es relativamente alta.
Aun el mas escaso, el Tulio, es tan común como el Bismuto y mas ordinario que el As, Se, Hg y Cd, a los que en general no se los considera como raros. Existen depósitos cuantiosos en Escandinavia, India, Rusia y EE.UU.; los muchos depósitos de menor tamaño están distribuidos en muchos otros lugares. Dichos depósitos están constituidos por muchos minerales, siendo la monacita , uno de los mas importantes y se presenta casi siempre como una arena pesada y oscura de composición variable. La monazita es en esencia un ortofosfato de lantánidos, pero se encuentran cantidades significativas de Th, arriba de un 30% en la mayoría de las arenas de monazita. La distribución individual de los lantánidos en los minerales es tal, que general el La, Ce, Pr y Nd constituyen aproximadamente el 90 %, estando el resto formado por el Y junto con los elementos mas pesados. La monazita y otros minerales que contienen lantánidos en el estado de oxidación +3 son por lo general pobres en Eu, el que debido a su tendencia relativamente fuerte de dar el estado +2, se concentra con mas frecuencia en los minerales del grupo AII.
En la naturaleza solo se encuentran trazos de Prometio en los minerales de Uranio como un fragmento resultante de la fisión espontánea 238U .Por métodos de intercambio de iones se pueden separar cantidades en miligramos de sales del 147Pm+, a partir de los productos de fisión de los reactores donde se forma el 147Pm(b-,2,64 años).
Los lantánidos se separan de la mayoría de los otros elementos por precipitación de oxalatos o fluoruros de soluciones ácido nítrico. Los elementos se separan entre si por intercambio de iones, el cual para fines comerciales se efectúa en gran escala. Por lo común, se separan inicialmente el Ce y Eu, el primero por oxidación a Ce+4 y precipitando luego el IO3- que es insoluble en HNO3 6N o bien por extracción por solventes; el Eu se separa por reducción a Eu+2 precipitándolo luego como EuSO4.
El comportamiento en el proceso de intercambio de iones depende principalmente del Radio ionico hidratado, y el lantano deberá estar enlazado de manera mas estrecha que el Lu; por tanto, el orden de elucion es de Lu ® La.
A pesar de que el Ce+4 (también el Th+4 y el Pu+4 ) se extrae fácilmente de las soluciones de HNO3 con fosfato de tributilo en querosina, los nitratos trivalentes de lantánidos también se pueden extraer en condiciones apropiadas, usando diversos esteres de fosfatos ácidos. La facilidad de extracción en determinadas condiciones se incrementa con el aumento de Z; es mayor en ácidos fuertes o en altas concentraciones de nitratos.
Los elementos
Cerio
Peso atómico: 140.12
Configuración electrónica: 1s2 2s2 2p3 3s2 3p6 3d10 4s2p6 4d10 4f2 6s2
Densidad: 6.78
Punto de Fusión: 640ºC
Punto de Ebullición: 3257
Electronegatividad (Pauling): 1.1
Calor de vaporización (Kcal/Mol): 95
Calor de fusión (Kcal/Mol): 1.2
Valencias: +3, +4, -1, -3, -4
Óxidos: Ce2O3 (ceroso), CeO2 (cerico), CeO3 (peróxido)
Hidratos: CeO3H3 (ceroso), CeO4H4 (cerico)
Valencias: Conviene notar que el Ti y el Ce que pertenecen a las primeras semiseries positivas del 3º y 4º periodo, presentan valencia variable, mientras que el Zr y Th pertenecen a la segunda semiserie tienen valencia fija.
Metal: El Ce tiene un color gris de acero brillante es dúctil, maleable y blando casi como el Pb de modo que se deja cortar en laminas por un cortaplumas.
Es inestable en el aire seco, pero se cubre de una capa de oxido en el aire húmedo. Da chispas con el eslabón cuando esta aleado con Fe (Piedras de los encendedores). En el Oxigeno arde entre 150ºC y 180ºC. Los ácidos diluidos lo atacan con facilidad y aun el agua es descompuesta poco a poco.
Óxidos e hidratos: Se conocen el oxido ceroso, el oxido cérico y otros óxidos salinos en que hay proporciones diferentes de los dos anteriores. También existe un peróxido cérico que se obtiene por acción del agua oxigenada.
El oxido ceroso es blanco grisáceo, y se disuelve fácilmente en los ácidos. El oxido cérico, que es principalmente amarillo cuando es puro, y no esta calcinado: cuando se calienta, se vuelve anaranjado, y a temperaturas de cerca de 1500ºc incoloro. Todos los óxidos del cerio, calcinados al aire se convierten en oxido cérico, perdiendo o absorbiendo oxigeno del aire.
Los álcalis fundidos no atacan al oxido cérico; pero se disgrega fácilmente, fundiéndolo con bisulfato de potasio.
Cuando el oxido cérico ha sido fuertemente calcinado, no se disuelve en los ácidos clorhídrico y nítrico concentrados, pero se disuelve en acido sulfúrico concentrado y en caliente, dando sulfato ceroso y desprendiendo oxigeno.
3H2SO4 + 2CeO2 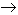 Ce2(SO4)3 +
3H2O + O
Ce2(SO4)3 +
3H2O + O
Cuando al acido clorhídrico o nítrico se le añaden un reductor (agua oxigenada, yoduro de potasio, sulfato ferroso, etc.), el oxido cérico, calcinado se disuelve al igual que en el acido yodhídrico.
4HI + CeO2 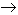 CeI2 +
I + 2H2O
CeI2 +
I + 2H2O
Los únicos compuestos binarios con valencia +4 que se conocen son el oxido, el oxido hidratado, CeO2 -H2O, y el fluoruro.
Praseodimio
El praseodimio es un metal amarillento que se empaña fácilmente, soluble en ácidos diluidos. En la naturaleza solo existe un isótopo de este elemento, de número másico 141; existen además 14 radioisótopos, de números másicos entre 134 y 148. Se emplea su oxido en la fabricación de arcos de incandescencia de carbón, utilizados en focos y proyectores. Sus sales se emplean en como colorantes de vidrios y esmaltes, también se usa en la fabricación de piedras para encendedores.
Constantes físicas y químicas del praseodimio
Masa atómica (uma): 140.9077
Configuración electrónica: 1s22s22p63s23p63d104s24p64d104f35s25p6
Punto de fusión (ºC): 930
Punto de ebullición (ºC): 3020
Densidad (g/cm3): 6.78
Electronegatividad (Pauling): 1.1
Estados de oxidación mas estables: +3, +4
Neodimio
Constantes físicas y químicas del neodimio
Masa atómica (uma): 144.24
Configuración electrónica: 1s22s22p63s23p63d104s24p64d104f145s25p66s2
Punto de fusión (ºC): 1024
Punto de ebullición (ºC): 3027
Densidad (g/cm3): 7.004
Electronegatividad (Pauling): 1.2
Estados de oxidación mas estables: +3
El neodimio es un metal amarillento, blando y moldeable, soluble en ácidos diluidos. Es irritante para los ojos y abrasivo para la piel. Se obtiene a partir de sus minerales monacita, bastanita y alanita, que son craqueados por calentamiento con ácido sulfúrico. Se utiliza en la fabricación de vidrios coloreados para lentes astronómicas y láseres y en investigación metalúrgica.
Promecio
Constantes físicas y químicas del promecio
Masa atómica (uma): 145
Configuración electrónica: 1s22s22p63s23p63d104s24p64d104f55s25p66s2
Punto de fusión (ºC): 1160
Densidad (g/cm3): 7.2
Estados de oxidación mas estables: +3
El promecio es un metal radioactivo, perteneciente al grupo de los lantanos, de color blanco argénteo. Es prácticamente inexistente en la naturaleza debido a la inestabilidad de todos sus isótopos. En la actualidad se conocen 14 de ellos, de números másicos comprendidos entre 141 y 154. El mas estable es el 14565Pm. El isótopo 147 se recupera de los productos de la fusión del uranio agotado; también se obtiene por reducción del cloruro o fluoruro con un metal alcalino. Se emplea en generadores nucleares como fuente de rayos X y como medidor de espesor.
Samario
Constantes físicas y químicas del samario
Masa atómica (uma): 150.4
Configuración electrónica: 1s22s22p63s23p63d104s24p64d104f65s25p66s2
Punto de fusión (ºC): 1072
Punto de ebullición (ºC): 1900
Densidad (g/cm3): 7.54
Electronegatividad (Pauling): 1.2
Estados de oxidación mas estables: +2, +3
El samario es un metal duro y quebradizo, de dureza similar a la del hierro y gran capacidad de absorción de neutrones. Se obtiene por reducción del oxido con bario y lantano. Se emplea como absorbente de neutrones, como contaminante de cristales láser y en la fabricación de magnetos permanentes.
Europio
El europio es un metal de color gris acerado, bastante blando y maleable. Se oxida rápidamente en el aire y es el mas reactivo de los elementos de las tierras raras o elementos de transición interna; en forma de polvo puede arder espontáneamente. Se obtiene por reducción del oxido con lantano. Se emplea como absorbente de neutrones en control nuclear; como activador del itrio para dar el color rojo en las pantallas de TV; como agente contaminador de láseres plásticos y en gomas de sellos de correos para permitir su identificación electrónica.
Constantes físicas y químicas del europio
Masa atómica (uma): 151.96
Configuración electrónica: 1s22s22p63s23p63d104s24p64d104f75s25p66s2
Punto de fusión (ºC): 826
Punto de ebullición (ºC): 1489
Densidad (g/cm3): 5.24
Estados de oxidación mas estables: +2, +3
Gadolinio
El gadolinio es un metal brillante que reacciona lentamente con el agua. Soluble en ácidos diluidos e insoluble en agua. Presenta un alto magnetismo, especialmente a bajas temperaturas. Se obtiene por reducción del fluoruro con calcio, y también por electrólisis, del cloruro con NaCl o Kcl. Se emplea en filtros para microondas, como activador del fósforo, como catalizador del oxigeno en la producción de titanio.
Constantes físicas y químicas del gadolinio
Masa atómica (uma): 157.23
Configuración electrónica: 1s22s22p63s23p63d104s24p64d105s25p6
Punto de fusión (ºC): 1312
Punto de ebullición (ºC): 3000
Densidad (g/cm3): 7.87
Electronegatividad (Pauling): 1.1
Estados de oxidación mas estables: +3
Terbio
Es un elemento de brillo metálico, reacciona con el agua y es soluble en ácidos diluidos. se separa de los óxidos de itrio y erbio mediante resinas cambiadoras de iones, y una vez obtenido el fluoruro, por reducción con calcio se obtiene el metal. Se emplea como activador de fósforos, en rayos láser y como contaminante de dispositivos semiconductores.
Constantes físicas y químicas del terbio
Masa atómica (uma): 158.9254
Configuración electrónica: 1s22s22p63s23p63d104s24p64d104f85s25p65d16s2
Punto de fusión (ºC): 1356
Punto de ebullición (ºC): 2800
Densidad (g/cm3): 8.332
Electronegatividad (Pauling): 1.2
Estados de oxidación mas estables: +4, +3
Disprosio
El disprosio es un metal que se encuentra en la naturaleza acompañando a los demás lantánidos, entre los que ocupa el séptimo lugar en abundancia. Reacciona lentamente con el agua, se disuelve fácilmente con ácidos diluidos y concentrados. Se obtiene por reducción del fluoruro con calcio. Forma un oxido con el estado de oxidación +4, DyO4, que solo es estable en estado sólido cristalino. Presenta también el estado de oxidación +3 en algunos compuestos como el DyF3 y Dy2O3.
Constantes físicas y químicas del disprosio
Masa atómica (uma): 162.5
Configuración electrónica: 1s22s22p63s23p63d104s24p64d105s25p6
Punto de fusión (ºC): 1407
Punto de ebullición (ºC): 2330
Densidad (g/cm3): 8.54
Estados de oxidación mas estables: +3, +4
Holmio
El holmio es un sólido brillante, soluble en ácidos diluidos. Se obtiene por reducción del fluoruro de calcio metálico. Se emplea en investigación, electroquímica y espectroscopia.
Constantes físicas y químicas del holmio
Masa atómica (uma): 164.93
Configuración electrónica: 1s22s22p63s23p63d104s24p64d104f115s25p66s2
Punto de fusión (ºC): 1461
Punto de ebullición (ºC): 2600
Densidad (g/cm3): 8.803
Estados de oxidación mas estables: +3
Erbio
El erbio es un sólido blanco, maleable de brillo metálico, soluble en ácidos e insoluble en agua. Presenta baja toxicidad y gran resistencia eléctrica. Se obtiene por reducción del fluoruro con calcio; también por electrólisis del cloruro fundido. A temperatura ambiente no es atacado por el oxigeno de la atmósfera. Se conocen sus haluros, nitrato, sulfato, oxalato, acetato y oxido, este ultimo de formula Er2O3. El erbio metálico se emplea en la obtención de aleaciones especiales, en la fabricación de láseres de temperatura ambiente y para colorear materiales cerámicos.
Constantes físicas y químicas del erbio
Masa atómica (uma): 167.26
Configuración electrónica: 1s22s22p63s23p63d104s24p64d104f125s25p66s2
Punto de fusión (ºC): 1552
Punto de ebullición (ºC): 2500
Densidad (g/cm3): 9.16
Electronegatividad (Pauling): 1.2
Estados de oxidación mas estables: +3
Tulio
El tulio es un sólido de brillo metálico soluble en ácidos diluidos que reacciona lentamente con el agua. El elemento natural consta de un solo isótopo, de numero másico 169; por bombardeo de neutrones lentos en un reactor nuclear se consiguen dos isótopos radiactivos, de números másicos 170 y 171. Se obtiene por reducción del fluoruro con calcio, el isótopo 170 se utiliza como fuente de rayos X.
Constantes físicas y químicas del Tulio
Masa atómica (uma): 168.9342
Configuración electrónica: 1s22s22p63s23p63d104s24p64d104f135s25p66s2
Punto de fusión (ºC): 1550
Punto de ebullición (ºC): 1727
Densidad (g/cm3): 9.318
Electronegatividad (Pauling): 1.2
Estados de oxidación mas estables: +3
Iterbio
Es un metal completamente maleable, soluble en ácidos diluidos y en amoniaco liquido. Tiene siete isótopos naturales, algunos de ellos radiactivos. Se obtiene extrayéndolo de mezclas de tierras raras. se emplea en rayos láser, como fuente de irradiación en equipos portátiles de rayos X y en investigación química.
Constantes físicas y químicas del Iterbio
Masa atómica (uma):173.04
Configuración electrónica: 1s22s22p63s23p63d104s24p64d104f145s25p66s2
Punto de fusión (ºC): 824
Punto de ebullición (ºC): 1427
Densidad (g/cm3): 7.01
Electronegatividad (Pauling): 1.1
Estados de oxidación mas estables: +3, +2
Lutecio
El lutecio es un metal blando y dúctil, soluble en ácidos diluidos y que reacciona lentamente con el agua. Se allá en muy pequeñas cantidades en los minerales donde se encuentran las otras tierras raras; su mena mas importante es la monacita. Se conocen dos isótopos estables, el 175 y el 176, y 17 radiactivos, de masas comprendidas entre 167 y 180. So obtiene por reducción del fluoruro con calcio. Se emplea en tecnología nuclear.
Constantes físicas y químicas del lutecio
Masa atómica (uma): 174.97
Configuración electrónica: 1s22s22p63s23p63d104s24p64d104f145s25p66s2
Punto de fusión (ºC): 1625
Punto de ebullición (ºC): 3327
Densidad (g/cm3): 9.852
Estados de oxidación mas estables: +3