El estado de oxidación, frecuentemente llamado número de oxidación, de un elemento es un concepto empírico definido como la carga iónica efectiva obtenida por exagerar el desplazamiento de los electrones en un enlace covalente y suponiendo que la transferencia es completa.
Por ejemplo, el compuesto cloruro de hidrógeno o ácido clorhídrico HCl está formado por los átomos H y Cl unidos mediante un par de electrones, uno procedente del H y el otro del Cl. Se representa electrónicamente por H:Cl, y el Cl atrae a los electrones de enlace con más intensidad que el H, debido a que tiene una carga nuclear mayor (Z=17) que la del H (Z=1). El resultado es que estos electrones se desplazan hacia el Cl. Es decir, hay un desplazamiento parcial de los electrones hacia el átomo de Cl. Este fenómeno lo representamos mediante H+Cl- y decimos que el número de oxidación del H es +1 y que el número de oxidación del Cl es -1.
Los estados de oxidación generalmente son representados por números enteros, que pueden ser positivos, negativos o cero. En algunos casos el estado de oxidación promedio de un elemento es una fracción, como por ejemplo 8/3 para el Hierro en la Magnetita (Fe3O4). El mayor número de oxidación conocido es +8 en los tetraóxidos (MO4) de rutenio, xenón, osmio, iridio, hassio, plutonio, y el curio, mientras que el estado de oxidación conocido más bajo es -4 para algunos elementos del grupo del carbono.
La oxidación fue estudiada por primera vez por Antoine Lavoisier, quien creía que la oxidación siempre era el resultado de reacciones con el oxígeno, y de ahí el nombre. Aunque se ha demostrado que la idea original de Lavoisier era incorrecta el nombre propuesto por él se sigue utilizando hasta el día de hoy, pero de una forma más general y no solo para referirse a reacciones con el oxígeno.
Los estados o números de oxidación fueron uno de los "peldaños" intelectuales que Mendeleev utilizó para obtener la tabla periódica. El concepto actual de estado de oxidación fue introducido en el año 1838 por W. M. Latimer. Luego en 1940 IUPAC recomendó el uso del término número de oxidación para reemplazar el número de Stock.
Cuando se habla del número de oxidación de un elemento hay que tener presente que el número de oxidación de los elementos químicos en los compuestos no tiene por qué ser siempre el mismo. Hay varios métodos para determinar el número de oxidación de un elemento químico, en un determinado compuesto. Uno de los más utilizados consiste en la aplicación de una serie de reglas que vamos a ver posteriormente. Las reglas, se basan en las ideas que los químicos han desarrollado sobre el proceso que siguen los átomos en las moléculas compartiendo sus electrones.
Estas reglas para asignar un número de oxidación a un elemento se aplican en un orden dado y debemos parar cuando se halla obtenido el número de oxidación, ya que una regla posterior podría contradecir una anterior.
Reglas para asignar el número de oxidación a un elemento
1. Los átomos en su forma elemental (elemento sin combinar) tienen un número de oxidación 0.
2. El número de oxidación de un ion monoatómico es igual al número de carga del ion.
3. La suma de los números de oxidación de todos los átomos, en las especies químicas, es igual a su carga total.
4. Para los elementos:
a) del grupo 1 (I) tienen número de oxidación +1;
b) del grupo 2 (II) tienen número de oxidación +2;
c) del grupo 13 (excepto el B) tienen número de oxidación +3 para iones M3+;
d) del grupo 14 (excepto C y Si) tienen número de oxidación +4 para M4+ y +2 para M2+.
5. Para el H el número de oxidación es +1 en su combinación con los no metales y -1 en su combinación con metales.
6. Para el F el número de oxidación es -1 en todos sus compuestos.
7. Para el O los números de oxidación son:
a) -2 a menos que se combine con el F;
b) -1 en los peróxidos (O2)2-;
c) -1⁄2 en superóxidos (O2)1-;
d) -1/3 en ozónidos (O3)1-.
Número de oxidación del carbono
El número de oxidación del carbono en los compuestos formados por la unión de varios átomos de C se determina de la siguiente forma: el C es cero respecto a otro C, negativo respecto al H y positivo respecto a los grupos que contengan O y N. Así, el H tiene un número de oxidación +1, el O tiene -2 y en los peróxidos -1, el N tiene -3 en aminas y +3 en nitrocompuestos.
Podemos establecer una serie de reglas para escribir los números de oxidación para los átomos de carbono:
1) Para obtener el número de oxidación del átomo de carbono, restamos el número de enlaces al hidrógeno del número de enlaces al oxígeno. Esto significa que por ejemplo para el carbono carbonilo, que tiene un doble enlace C=O, debemos contar los dos enlaces. Así para el acetaldehído, el átomo de carbono carbonilo tiene un número de oxidación de +1, y el carbono metílico tiene un número de oxidación de -3. Es importante hacer notar que los dos carbonos metílicos en el acetato de etilo no tienen el mismo número de oxidación, uno es de –3 y el otro de -2.
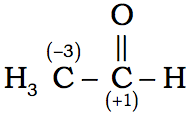
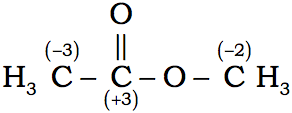
2) Los enlaces entre carbono y nitrógeno son tratados exactamente como enlaces entre carbono y oxígeno, ya que son más electronegativos que el carbono. En un enlace entre dos átomos de igual electronegatividad, como dos átomos de carbono, los electrones se considera que están compartidos por igual.