Urea, también conocida como carbamida, carbonildiamida o ácido arbamídico, es el nombre del ácido carbónico de la diamida. Cuya formula química es (NH2)2CO. Es una sustancia nitrogenada producida por algunos seres vivos como medio de eliminación del amoníaco, el cuál es altamente tóxico para ellos. En los animales se halla en la sangre, orina, bilis y sudor.
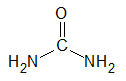
La urea se presenta como un sólido cristalino y blanco de forma esférica o granular. Es una sustancia higroscópica, es decir, que tiene la capacidad de absorber agua de la atmósfera y presenta un ligero olor a amoníaco.
Comercialmente la urea se presenta en pellets, gránulos, o bien disuelta, dependiendo de la aplicación.
Propiedades
| Peso molecular | 60.06 g/mol |
| Densidad | 768 Kg/m3 |
| Punto de fusión | 132.7 ºC |
| Calor de fusión | 5.78 a 6 cal/gr |
| Calor de combustión | 2531 cal/gr Humedad crítica relativa (a 30°C): 73% |
| Acidez equivalente a carbonato de calcio | 84 (Partes de carbonato de calcio necesarias para neutralizar el efecto acidificante de 100 partes de urea) |
| Índice de salinidad | 75.4 |
| Calor de disolución en agua | 57.8 cal/gr (endotérmica) |
| Energía libre de formación a 25 ºC | 47120 cal/mol (endotérmica) |
| Corrosividad | altamente corrosivo al acero al carbono. Poco al aluminio, zinc y cobre. No lo es al vidrio y aceros especiales |
La urea es una sustancia no peligrosa, no tóxica, no cancerígena y tampoco es inflamable aunque si es levemente irritante en contacto en los ojos y piel.
Es explosivo si se mezcla con agentes reductores fuertes, como hipoclorito y por termo descomposición, produce gases inflamables y tóxicos (NH3 y CO2)
Solubilidad
Es muy soluble en agua, alcohol y amoníaco. Poco soluble en éter y otros a temperatura ambiente. Ver tablas.
Solubilidad en agua
| Temperatura (ºC) |
Gramos/100gr sc |
|---|---|
| 20 | 52 |
| 30 | 62.5 |
| 60 | 71.5 |
| 80 | 80 |
| 100 | 88 |
Solubilidad en alcoholes
| Alcohol |
Gramos/100gr sc |
|---|---|
| Metanol | 27.7 |
| Etanol | 7.2 |
| n-propanol | 3.6 |
| Isobutanol | 2.3 |
Principales reacciones
Por termo descomposición, a temperaturas cercanas a los 150 – 160 ºC, produce gases inflamables y tóxicos y otros compuestos. Por ejemplo amoníaco, dióxido de carbono, cianato de amonio (NH4OCN) y biurea HN(CONH2)2. Si se continúa calentando, se obtienen compuestos cíclicos del ácido cinabrio.
Soluciones de urea neutras, se hidrolizan muy lentamente en ausencia de microorganismos, dando amoníaco y dióxido de carbono. La cinética aumenta a mayores temperaturas, con el agregado de ácidos o bases y con un incremento de la concentración de urea.
Urea en la naturaleza
La urea es producida por los mamíferos como producto de la eliminación del amoníaco, el cuál es altamente tóxico para los mismos. El llamado ciclo de la urea, es el proceso que consiste en la formación de urea a partir de amoníaco. Es un proceso que consume energía, pero es indispensable para el quimismo vital. En los humanos al igual que en el resto de los mamíferos, la urea es un producto de desecho, producido cuando el cuerpo ha digerido las proteínas. Esta es llevada a través de la sangre a los riñones, los cuales filtran la urea de la sangre y la depositan en la orina. Un hombre adulto elimina aproximadamente unos 28 g de urea por día.
Por otra parte, se encuentran en el suelo numerosas bacterias que liberan una enzima llamada ureasa. La ureasa es una enzima hidrolítica que cataliza la reacción de descomposición de urea por el agua, con formación de una molécula de anhídrido carbónico y dos moléculas de amoníaco.
De ésta forma vemos que en dos situaciones distintas, en la naturaleza se verifica la reacción en ambos sentidos.
Usos y aplicaciones
Los principales usos de la urea son:
Fertilizante
El 90% de la urea producida se emplea como fertilizante. Se aplica al suelo y provee nitrógeno a la planta. También se utiliza la urea de bajo contenido de biuret (menor al 0.03%) como fertilizante de uso foliar. Se disuelve en agua y se aplica a las hojas de las plantas, sobre todo frutales, cítricos.
La urea como fertilizante presenta la ventaja de proporcionar un alto contenido de nitrógeno, el cuál es esencial en el metabolismo de la planta ya que se relaciona directamente con la cantidad de tallos y hojas, las cuáles absorben la luz para la fotosíntesis. Además el nitrógeno está presente en las vitaminas y proteínas, y se relaciona con el contenido proteico de los cereales.
La urea se adapta a diferentes tipos de cultivos.
Es necesario fertilizar, ya que con la cosecha se pierde una gran cantidad de nitrógeno.
El grano se aplica al suelo, el cuál debe estar bien trabajado y ser rico en bacterias. La aplicación puede hacerse en el momento de la siembra o antes. Luego el grano se hidroliza y se descompone:
NH2 – CO – NH2![]() 2NH3 +
CO2
2NH3 +
CO2
Debe tenerse mucho cuidado en la correcta aplicación de la urea al suelo. Si ésta es aplicada en la superficie, o si no se incorpora al suelo, ya sea por correcta aplicación, lluvia o riego, el amoníaco se vaporiza y las pérdidas son muy importantes. La carencia de nitrógeno en la planta se manifiesta en una disminución del área foliar y una caída de la actividad fotosintética.
Fertilización foliar
La fertilización foliar es una antigua práctica, pero en general se aplican cantidades relativamente exiguas en relación a las de suelo, en particular de macronutrientes. Sin embargo varios antecedentes internacionales demuestran que el empleo de urea bajo de biuret permite reducir las dosis de fertilizantes aplicados al suelo, sin pérdida de rendimiento, tamaño y calidad de fruta. Estudios realizados en Tucumán demuestran que las aplicaciones foliares de urea en bajas cantidades resultan tan efectivas como las aplicaciones al suelo. Esto convalida la practica de aplicar fertilizantes junto con las aplicaciones de otros agroquímicos como complemento de un programa de fertilización eficiente.
Industria química y plástica
Se encuentra presente en adhesivos, plásticos, resinas, tintas, productos farmacéuticos y acabados para productos textiles, papel y metales.
Como suplemento alimentario para ganado
Se mezcla en el alimento del ganado y aporta nitrógeno, el cuál es vital en la formación de las proteínas.
Producción de resinas
Como por ejemplo la resina urea-formaldehído. Estas resinas tienen varias aplicaciones en la industria, como por ejemplo la producción de madera aglomerada. También se usa en la producción de cosméticos y pinturas.