Ground state of the atom
Por Heber Gabriel Pico Jiménez MD
Resumen
En este trabajo gracias a la nueva regla del octeto se logra concebir el estado fundamental del átomo como sistema en condiciones normales de presión y temperatura, que ayuda comprender, a un fenómeno que la teoría de los orbitales moleculares no puede explicar. Ese fenómeno es nada menos y nada más que el enlace de coordinación. Es el enlace que brinda quizás la mayor estabilidad molecular posible que se pueda alcanzar debido que además de tener como substrato al átomo en estado fundamental, también altera de forma contraria a la carga eléctrica original del elemento en la respectiva molécula. Por esta razón es el enlace propio para la catenación. Tras esto se revela que los elementos del grupo del carbono, son los únicos átomos que tienen dos estados de excitación. Se demuestra que el estado fundamental y excitado en el grupo de los alcalinos y los halógenos, es el mismo. Se declara la estructura del oxígeno triplete y su semejanza molecular y eléctrica con el monóxido de carbono. Se encuentra que los enlaces del carburo de calcio son todos enlaces de coordinación. Hallamos que la catenación del carbono se origina, a partir de un carbono semi-excitado y el enlace es de coordinación continua. Se halla también que la catenación del azufre, surte efecto a partir del azufre en estado fundamental, que se unen también a través de un enlace de coordinación.
Palabras claves: Células Fotoeléctricas, Células Fotovoltaicas, Panel Solar.
Abstract
In this work thanks to the new rule of byte is accomplished conceive of the ground state of the atom as a system, in normal conditions of pressure and temperature, which helps understand, a phenomenon that cannot be explained by molecular orbital theory. That phenomenon is nothing less and nothing more than the coordination link. It is the link that provides perhaps the possible molecular stability which can be achieved because that besides having as a substrate to the atom in ground state also alters in any manner contrary to the original electrical load of the element in the corresponding molecule. For this reason it is the link to the catenation. He is revealed that elements of the carbon group, are only atoms that have two States of excitation. She is running the curtain that the State fundamental and excited in the alkali and halogens, group is the same. Declares the structure of the oxygen triplet and its electrical and molecular similarity with carbon monoxide. It is that calcium carbide links are all links of coordination. It is is correct that the catenation of carbon originates, from a semi-excitado carbon and the link is continuous coordination. It is also that the catenation of sulphur, takes effect from sulfur in ground state, which also join through a coordination link.
Keywords: Photoelectric cells, photovoltaic cells, Solar Panel.
1. Introducción
Precisamos que todo el desarrollo de este artículo, estará siempre sostenido en el principio de que químicamente los electrones por lo general, estarán casi siempre apareados. Bajo este principio se desarrollan los anteriores trabajos de energía atómica Número cuántico magnético del electrón, el trabajo de la superconductividad, el artículo del acoplamiento espín-órbita del electrón, además el anterior trabajo de Semiconductores y el de Células fotoeléctricas publicado en textoscientificos y Monografías. También este artículo se basa en la nueva regla del octeto.
En la molécula de monóxido de carbono el átomo de carbono se comporta como un nucleófilo rico en electrones es decir como un carbanión.
2. Desarrollo del Tema.
Se logra entender que a determinada temperatura cualquiera que fuera, incluso a temperaturas extremadamente bajas, la organización de los electrones y los huecos de la capa de valencia en un átomo, tiene distribución distinta.
A temperaturas normales, los átomos se encuentran en diferentes niveles de energía y sin formar enlaces aun tendrán, una determinada organización de electrones y huecos en la capa de valencia que sería una organización fundamental de valencia determinada a esa temperatura.
Un átomo puede estar excitado a mucha menor energía del estado fundamental es decir, la cantidad de energía en el estado fundamental no es la que define el estado de excitación, podría estar excitado a menor o mayor energía de la cantidad energética que alcanza el equilibrio en el estado fundamental.
No podemos establecer que un estado excitado, en un sistema a determinada temperatura ni siquiera la del punto cero, es solamente cualquier estado cuya energía sea mayor que la energía del estado fundamental.
El estado fundamental de un átomo, es el estado organizacional sin reacción química de la capa de valencia del elemento a determinada temperatura.
La catenación es la capacidad que tiene un elemento químico, para formar estructuras de cadena larga con una serie de enlaces covalentes.
La catenación se da más estable en el carbono quien forma enlaces covalentes de dos electrones con otros átomos de carbono.
El carbono es muy bien conocido por sus propiedades de catenación, con lo que la química orgánica es, esencialmente, el estudio de las estructuras del carbono catenado.
Según la nueva regla del octeto, los elementos que menor fuerza de repulsión presentan en estado fundamental, son los átomos del grupo del carbono debido a que en su capa de valencia tienen 4 electrones de carga negativa y a 4 huecos de carga contraria.
Sin embargo el carbono no es el único elemento capaz de formar estructuras catenadas y algunos otros elementos, también son capaces de formar un gran rango de cadenas.
La maña de un elemento para catenarse está basada principalmente en la energía de los enlaces que sea suficiente y alcance a soportar, la repulsión electrostática, que ocasiona la misma de la carga eléctrica, en este momento interviene el grado de repulsión y la capacidad del elemento, a través del enlace de coordinación, para alterar su carga eléctrica, en busca de generar dipolos entre los átomos adyacentes para fortalecer la energía de los enlaces entre ellos mismos. En otras ocasiones los enlaces también serán endurecidos por la presencia de otros enlaces colaterales.
ÁTOMO de FLÚOR en ESTADO FUNDMENTAL y EXCITADO
El estado fundamental y el estado excitado del flúor, son los mismos es decir, los halógenos siempre están excitados. Además el grado de repulsión electrostática de los elementos del octeto de la valencia entre dos halógenos en estado fundamental es máximo, al igual que en los alcalinos.

Átomos de Flúor donde el estado fundamental y excitado es idéntico. Los pequeños círculos rellenos de verde y azul corresponden a los electrones de valencia del átomo que tenga su mismo color y los pequeños círculos vacíos son los huecos del átomo que tenga su mismo color de línea.
Fig. No.1.
ÁTOMO de OXÍGENO en ESTADO EXCITADO y FUNDAMENTAL
El átomo de oxígeno de acuerdo así está en el estado excitado o en estado fundamental, puede llegar a tener los electrones de valencia distribuidos de las dos maneras siguientes:
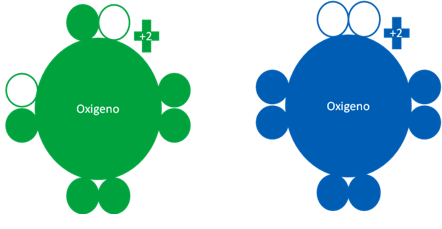
Átomos de oxígeno donde el átomo de la izquierda corresponde a un átomo de oxígeno excitado mientras el oxigeno de la derecha, es un átomo de oxígeno en estado fundamental. Los pequeños círculos rellenos de verde y azul corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea.
Fig. No.2
Los elementos del octeto de la valencia de los anfígenos en estado fundamental, tienen menor repulsión que los halógenos pero no deja de ser intensa e igual que la de los alcalinoterreos.
OXÍGENO TRIPLETE
El oxigeno triplete es el oxígeno molecular formado por dos átomos de oxígeno entre los cuales uno de ellos tiene estado fundamental y el otro oxígeno se encuentra en estado excitado. La carga eléctrica original de los respectivos átomos de oxígenos sufre alteración de forma contraria y por eso, el oxígeno triplete es paramagnético. A pesar de que uno de los átomos del oxígeno triplete, que precisamente está ubicado a la izquierda de la siguiente figura del oxigeno triplete, a pesar de que él internamente tiene una carga eléctrica de cero, sin embargo en la molécula del dioxígeno triplete juega con una carga eléctrica negativa con respecto al otro oxígeno del respectivo dioxígeno.

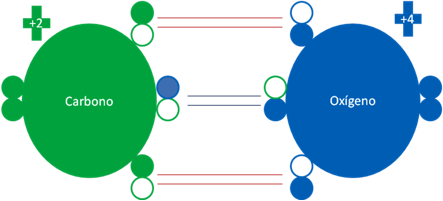
Átomos de oxígenos en estados fundamentales y excitados juntos
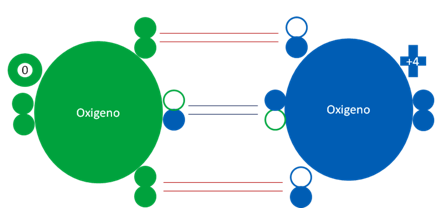
Hay un solo enlace de coordinación central entre los dos oxígenos representado por el par de barras horizontales de color azul oscuro. Hay dos enlaces de tres electrones representados cada uno por un par de barras de color rojo. El anillo de color verde indica la carga eléctrica nula o cero del oxigeno del extremo izquierdo. Los pequeños círculos rellenos de distintos colores corresponden a los electrones del átomo del mismo color. Los pequeños círculos vacíos corresponden a los huecos del átomo que tiene su mismo color de línea.
Fig. No.3.
OXÍGENO SINGLETE
El oxígeno singlete es el oxígeno molecular formado por la unión de dos átomos de oxígeno en estados excitados. La carga eléctrica de los átomos de oxígenos permanece constante y no se altera. Es una molécula donde los átomos de oxígeno, a pesar de que los unen dos enlaces covalentes fuertes de dos electrones, no son suficientes para brindarles la estabilidad necesaria ni tampoco es paramagnética, esto es debido a la repulsión electrostática que ocurre entre los dos oxígenos por el hecho de tener la misma carga eléctrica.
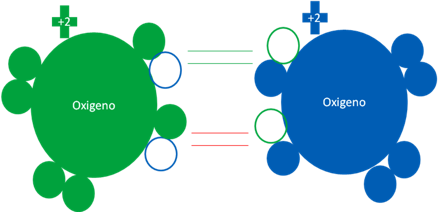
Hay dos enlaces covalentes de coordinación reciproca y los pares de barras horizontales de color verde y rojo, representa a los enlaces covalentes de coordinación. Los pequeños círculos rellenos de distintos colores corresponden a los electrones del átomo del mismo color. Los pequeños círculos vacíos corresponden a los huecos del átomo que tienen su mismo color de línea.
Fig. No.4.
OZONO
El ozono es aquel trioxígeno que se puede formar a partir de la unión de tres átomos de oxígeno en estados fundamentales.
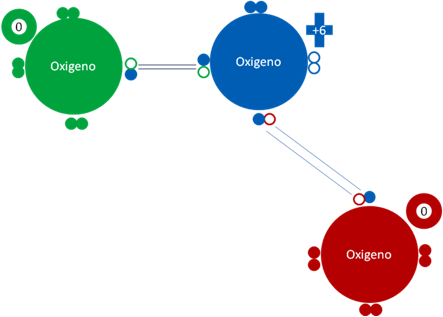
Tres átomos de oxígenos que están unidos por dos enlaces coordinados distintos donde el átomo de oxígeno central, es relativamente positivo (+6) y los oxígenos de los extremos (0) son dos oxígenos de cargas relativamente negativas e iguales con respecto al oxígeno central (+6). Los pequeños círculos rellenos de distintos colores corresponden a los electrones del átomo del mismo color. Los pequeños círculos vacíos corresponden a los huecos del átomo que tienen su mismo color de línea.
Fig. No. 5.
MONÓXIDO DE AZUFRE
El monóxido de azufre es una molécula semejante al oxigeno singlete. Tiene dos enlaces covalentes de dos electrones compartidos.
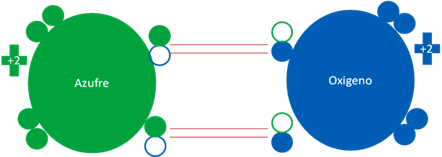
Monóxido de azufre.
Figura No.6.
DIÓXIDO DE AZUFRE
El átomo de azufre con cada oxígeno tiene a un enlace covalente de dos electrones compartidos y además, tiene con cada uno de ellos un enlace hipervalente. De los 4 enlaces que tiene el azufre del dióxido, dos de ellos son enlaces hipervalentes y dos son enlaces covalentes compartidos.
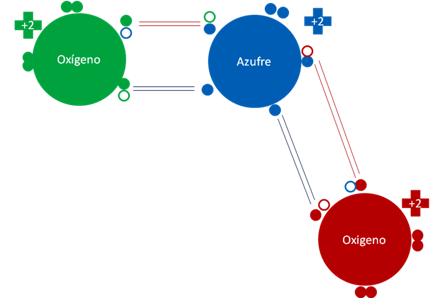
Dióxido de azufre. Las barras de color rojo representan a dos enlaces covalentes que comparten a dos electrones, las barras de color azul oscuro representan a dos enlaces hipervalentes.
Figura No.7.
TRIOXIDO DE AZUFRE
El trióxido de azufre tiene un oxígeno unido por solo enlaces hipervalentes mientras los dos oxígenos restantes, tienen un enlace hipervalente y un enlace covalente que comparte a dos electrones.
De los seis (6) enlaces que tienen el azufre en el respectivo trióxido del elemento, cuatro (4) de ellos son enlaces hipervalentes y solo dos de estos, son enlaces covalentes que comparte a dos electrones quienes en un futuro van a ser los enlaces de los OH del acido sulfúrico.
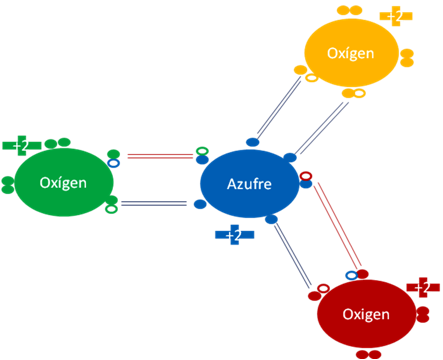
Trióxido de oxígeno. Los cuatro pares de barras en color azul oscuro representan a los enlaces hipervalentes, los dos pares de barras en color rojo representan a los enlaces covalentes que comparten dos electrones cada uno. Los pequeños círculos rellenos de distintos colores corresponden a los electrones del átomo del mismo color. Los pequeños círculos vacíos corresponden a los huecos del átomo que tienen su mismo color de línea.
Figura No.8.
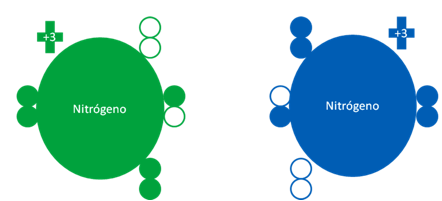
ÁTOMO de NITRÓGENO en ESTADO FUNDAMENTAL y EXCITADO
El átomo de nitrógeno de acuerdo de que si se encuentra en estado fundamental o excitado, puede llegar a tener los electrones de valencia distribuidos de las dos siguientes maneras:
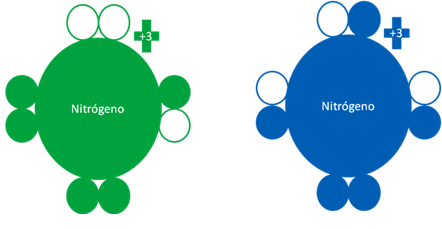
Dos átomos de nitrógenos donde el átomo de la izquierda corresponde a un átomo de nitrógeno en estado fundamental mientras el nitrógeno de la derecha, es un átomo de nitrógeno en estado excitado. Los pequeños círculos rellenos de verde y azul son los electrones de valencia del átomo que tenga su mismo color y los pequeños círculos vacíos son los huecos del átomo original que tenga su mismo color de línea.
Fig. No.9.
El átomo de nitrógeno en estado fundamental tiene a un par de huecos libres, tiene también a dos pares de electrones libres y además a un electrón apareado de forma mixta con un hueco.
La valencia del nitrógeno tiene menos repulsión electrostática que los anfígenos pero es mayor que la del grupo del carbono.
NITRÓGENO DIATÓMICO
En el nitrógeno diatómico los dos nitrógenos tienen la misma carga eléctrica pero son el estado fundamental de los átomos, estan unidos por dos enlaces coordinados y un enlace covalente ordinario de dos electrones.
Dos átomos de Nitrógeno en estado fundamental. Los pequeños círculos rellenos de verde y azul son los electrones de valencia del átomo que tenga su mismo color y los pequeños círculos vacíos son los huecos del átomo original que tenga su mismo color de línea.
Fig. No.10.
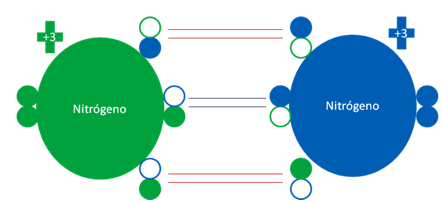
Los enlaces identificados por un par de barras horizontales de color rojo de los extremos superior e inferior de la figura son dos enlaces de coordinación reciproca mientras, el par de barras horizontales y centrales de color azul oscuro representan a un enlace covalente de dos electrones compartidos. Los pequeños círculos rellenos de distintos colores corresponden a los electrones del átomo del mismo color. Los pequeños círculos vacíos corresponden a los huecos del átomo original que tienen su mismo color de línea.
Fig. No.11.
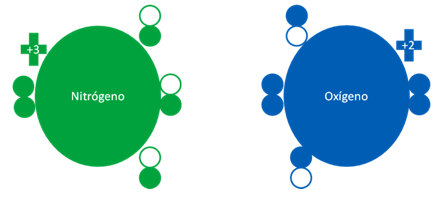
MONÓXIDO de NITRÓGENO a partir del NITROGENO y el OXÍGENO FUNDAMENTAL
El monóxido de nitrógeno se puede formar cuando se unen un átomo de nitrógeno no excitado con otro átomo de oxigeno, también sin estar excitado.

Átomos de nitrógeno y oxígenos en estados fundamentales.

Átomos de nitrógeno y oxígenos en estados fundamentales.
Las barras largas horizontales de color rojo, representan a dos enlaces de coordinación reciproca. Las barras cortas de color azul oscuro representan a un débil enlace de tres electrones. Los pequeños círculos rellenos de verde y azul son los electrones de valencia del átomo que tenga su mismo color y los pequeños círculos vacíos son los huecos del átomo original que tenga su mismo color de línea.
Fig. No.12.
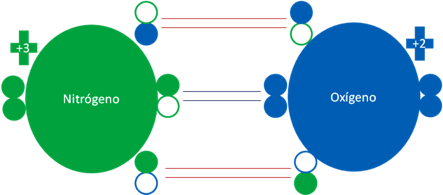
MONÓXIDO de NITRÓGENO a partir del NITRÓGENO EXCITADO y el OXÍGENO también debidamente EXCITADO
El monóxido de nitrógeno también se puede formar cuando se unen un átomo de nitrógeno excitado con otro átomo de oxigeno también excitado.

Átomos de nitrógeno y oxígenos excitados.
Átomos de nitrógeno y oxígenos excitados.
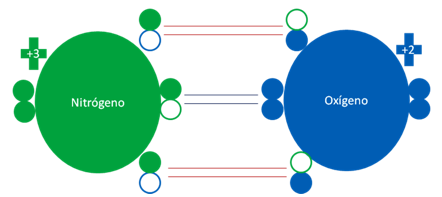
Las barras largas horizontales de color rojo, representan a dos enlaces covalentes con dos electrones compartidos. Las barras cortas de color azul oscuro representan a un débil enlace de tres electrones. Los pequeños círculos rellenos de verde y azul son los electrones de valencia del átomo que tenga su mismo color y los pequeños círculos vacíos son los huecos del átomo original que tenga su mismo color de línea.
Fig. No.13.
ÁTOMO de CARBONO en ESTADO FUNDAMENTAL y EXCITADO
El átomo de carbono tiene un solo estado fundamental y dos estados excitados y de acuerdo de que si se encuentra en estado fundamental o excitado, puede llegar a tener los electrones de valencia distribuidos de las tres siguientes maneras:
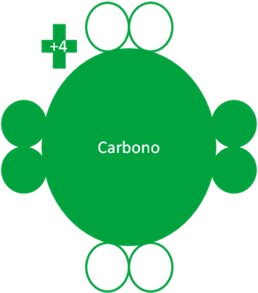
Átomo de carbono en estado fundamental. Los pequeños círculos rellenos de verde son los electrones de valencia y los pequeños círculos vacíos son los huecos.
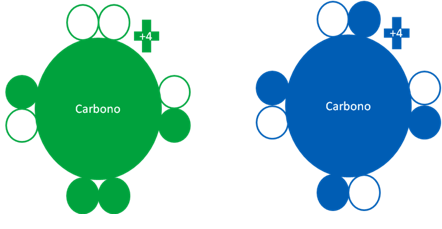
Átomos de carbonos en estados excitados donde el átomo de la izquierda corresponde a un tipo de átomo de carbono semi-excitado mientras el carbono de la derecha, es un átomo de carbono en estado totalmente excitado. Los pequeños círculos rellenos de azul y verde son los electrones de valencia en ambos átomos y los pequeños círculos vacíos son los huecos.
Fig. No.14.
Al átomo de flúor con su carga eléctrica de +1, le es incompetente un solo enlace covalente compartido de dos electrones, sobretodo porque es una molécula diatómica no polar. En disolución acuosa el flúor se presenta en forma de ión fluoruro.
En el oxigeno vemos que con una carga eléctrica de +2, hay menos repulsión electrostática que en los halógenos pero además de no servirle un enlace covalente para mantenerse de forma apolar, no le sirven ya dos enlaces y le deja aun, con muy poca estabilidad al oxígeno singlete y es necesario que se forme el oxígeno triplete, quien establece dos enlaces de tres electrones y un enlace coordinado que les concede mayor estabilidad por la distinta carga eléctrica que genera a los dos oxígenos que integran a la respectiva molécula.
En el nitrógeno que tiene menos repulsión puede mantenerse apolar con una carga eléctrica de +3, pero tiene que recurrir a dos enlaces de coordinación y además, necesita la ayuda de un enlace covalente compartido de dos electrones.
CARBURO de CALCIO
El carburo de calcio se genera en arco eléctrico a partir del oxido de calcio y el coque. El átomo de carbono en este proceso se encuentra los dos átomos de carbonos en estados fundamentales.

Átomos de carbonos, ambos en el estado fundamental. Los pequeños círculos rellenos de verde y azul son los electrones de valencia del átomo que tiene el mismo color y los pequeños círculos vacíos son los huecos del átomo original que tiene el mismo color de línea.
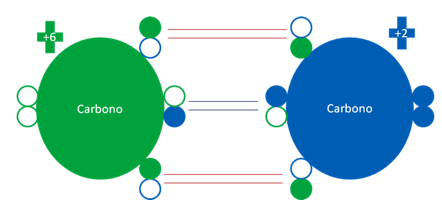
Átomos de carbonos ambos en estado fundamental unidos por 3 enlaces de coordinación. Los pequeños círculos rellenos de azul y verde corresponden a los electrones de valencia del átomo original que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo original que tiene su mismo color de línea. Los dos átomos de carbono tienen caga eléctrica distinta.
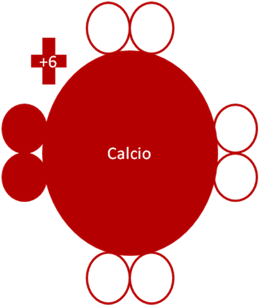
Átomo de calcio en estado fundamental. La carga eléctrica del calcio es +6. Los pequeños círculos rellenos de rojo corresponden a los electrones de valencia del átomo original que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo original que tiene su mismo color de línea.
Fig. No.15
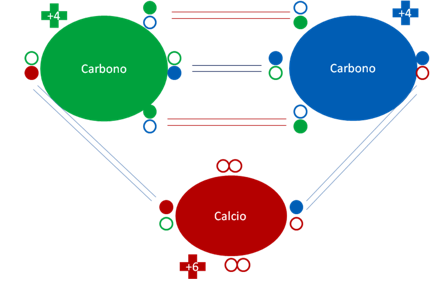
Carburo de calcio. Los pequeños círculos rellenos de azul y verde corresponden a los electrones de valencia del átomo que tiene su mismo color y los pequeños círculos vacíos son los huecos del átomo que tiene su mismo color de línea. Los átomos de carbono y calcio tienen la misma carga original.
Fig. No.16.
El átomo de calcio tiene por el extremo derecho como receptor a un par de huecos para configurar por un lado, un enlace de coordinación y por el otro lado izquierdo actúa como dador de otro enlace también de coordinación.
El átomo de carbono que tiene una carga eléctrica de +4 y presenta la menor repulsión electrostática para mantenerse neutral, sin embargo ya no le sirven únicamente las herramientas del nitrógeno, que son dos enlaces coordinados y un enlace covalente compartido de dos electrones, pues para utilizar los mismas estrategias e instrumentos del nitrógeno, tiene que hacerlo con átomos de carbonos excitados como en el grafito o establecer por lo menos un enlace covalente adicional estabilizador con un elemento distinto al carbono como el hidrógeno en el acetileno incluso, puede quedarse con los dos enlaces coordinados con el mismo átomo de carbono y hacer dos enlaces covalentes compartidos con otro hidrógeno distinto como en el etileno.
ACETILENO
Para formar el acetileno se hacen necesarios dos átomos de carbono en estados semi-excitados:

Átomos de carbonos donde ambos corresponden a un tipo de átomos de carbono en estado semi-excitados. Los pequeños círculos rellenos de colores corresponden a los electrones de valencia del átomo que tenga el mismo color y los pequeños círculos vacíos son los huecos del átomo original que tenga el mismo color de línea.
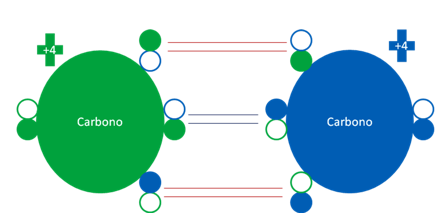
Átomos de carbono donde ambos átomos corresponde a un tipo de átomo de carbono en estado semi-excitado. Los dos pares de barras horizontales de color rojo representan a dos enlaces de coordinación reciproca. El par de barra horizontales centrales de color azul oscuro representa al enlace covalente de dos electrones compartidos. Los pequeños círculos rellenos de colores corresponden a los electrones de valencia del átomo que tenga su mismo color y los pequeños círculos vacíos son los huecos del átomo original que tenga su mismo color de línea.
Fig. No.17.
MONÓXIDO DE CARBONO
El monóxido de carbono se puede formar por la combustión incompleta. Podría formarse a partir del átomo de carbono y oxígenos aun estando ambos en estado fundamental. También se puede originar a partir del estado semi-excitado del carbono, enfrente del estado excitado del oxígeno.
MONÓXIDO de CARBONO a partir del CARBONO y el OXIGENO FUNDAMENTAL
Es aquel que es formado por carbonos y oxígenos en estados fundamentales:
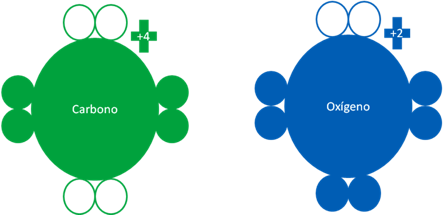
Átomos de carbono fundamental y el átomo de oxígeno en estado también fundamental. Los pequeños círculos rellenos representan a los electrones del átomo del mismo color y los círculos vacíos representan a los huecos del átomo original que tenga el mismo color de línea.
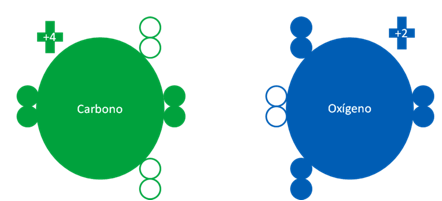
Átomos de carbono fundamental y el átomo de oxígeno en estado también fundamental. Los pequeños círculos rellenos representan a los electrones del átomo del mismo color y los círculos vacíos representan a los huecos del átomo original que tenga el mismo color de línea.

Átomos de carbono fundamental y el átomo de oxígeno en estado también fundamental. Los dos pares de barras horizontales de color rojo representan a dos enlaces de coordinación donde el oxigeno en los dos enlaces es el átomo dador. El único par de barras horizontales de color azul oscuro representan a otro enlace de coordinación pero esta vez el oxígeno es el receptor. Los pequeños círculos rellenos representan a los electrones del átomo del mismo color y los círculos vacíos representan a los huecos del átomo que tenga el mismo color de línea.
Fig. No.18.
MONÓXIDO de CARBONO a partir del CARBONO semi-excitado y el OXÍGENO EXCITADO
Es aquel que es formado a partir de un átomo de carbono semi-excitado y un átomo de oxígeno totalmente excitado.
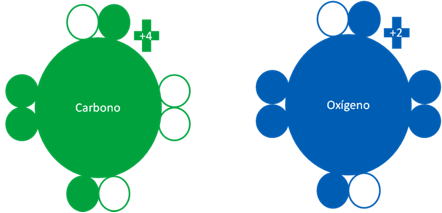
Átomo de carbono semi-excitado y el átomo de oxígeno en estado excitado. Los pequeños círculos rellenos representan a los electrones del átomo del mismo color y los círculos vacíos representan a los huecos del átomo que tenga el mismo color de línea.

Átomos de carbono semi-excitado y el átomo de oxígeno en estado excitado. Los pequeños círculos rellenos representan a los electrones del átomo del mismo color y los círculos vacíos representan a los huecos del átomo que tenga el mismo color de línea.
Átomo de carbono en estado semi-excitado enlazado 3 veces con un átomo de oxígeno en estado totalmente excitado. Los dos pares de barras horizontales de color rojo representan a dos enlaces covalentes de dos electrones compartidos. El par de barras horizontales de color azul oscuro representa al único enlace de coordinación donde el oxígeno es el átomo dador. Los pequeños círculos rellenos corresponden a los electrones de valencia del átomo que tenga su mismo color y los pequeños círculos vacíos son los huecos del átomo que tenga su mismo color de línea.
Fig. No.19.
COMPARACIÓN Molecular del MONÓXIDO de CARBONO con el OXÍGENO TRIPLETE
La molécula de oxígeno triplete tiene una estructura demasiado semejante con el monóxido de carbono.
Ambos están unidos por 3 enlaces. En el oxígeno molecular dos de esos tres enlaces son débiles porque son dos enlaces de 3 electrones mientras, que esos mismos dos sitios en el monóxido de carbono, son dos enlaces de coordinación o por lo menos, son enlaces covalentes que comparten cada uno a dos electrones.
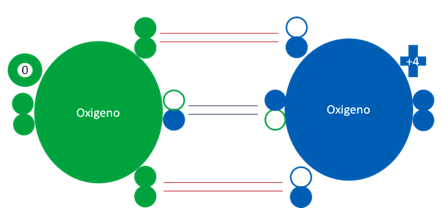
En la molécula de oxígeno triplete hay un solo fuerte enlace de coordinación central entre los dos oxígenos representado por el par de barras horizontales cortas de color azul oscuro. Hay dos enlaces débiles de tres electrones representados cada uno por un par de barras horizontales y largas de color rojo. El anillo de color verde indica la carga eléctrica nula o cero del oxígeno del extremo izquierdo. Los pequeños círculos rellenos de distintos colores corresponden a los electrones del átomo del mismo color. Los pequeños círculos vacíos corresponden a los huecos del átomo que tiene su mismo color de línea.
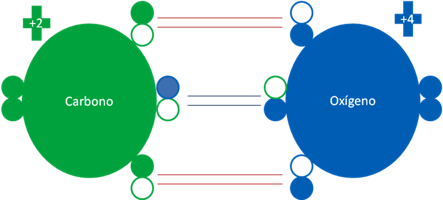
En la molécula del gas monóxido de carbono el átomo de carbono en estado semi-excitado enlazado 3 veces con un átomo de oxígeno en estado totalmente excitado. Los dos pares de barras largas horizontales de color rojo representan a dos fuertes enlaces covalentes de dos electrones compartidos. Además el par de barras cortas horizontales de color azul oscuro representa a otro fuerte enlace de coordinación donde el oxígeno es el átomo dador. Los pequeños círculos rellenos corresponden a los electrones de valencia del átomo que tenga su mismo color y los pequeños círculos vacíos son los huecos del átomo que tenga su mismo color de línea.
Fig. No.20.
El oxígeno del monóxido de carbono tiene la misma carga eléctrica (+4) del oxígeno excitado en la molécula triplete.
Aunque muy leve y menos que el oxígeno triplete, el monóxido carbono también es una molécula bipolar.
Ambas moléculas conservan a un par de electrones libres en los extremos de dichas estructuras moleculares.
CATENACIÓN del CARBONO
Para que un enlace covalente coordinado soporte la repulsión electrostática entre dos carbonos con igual carga eléctrica de +4 que es la menor de todas las existentes entre dos átomos que tengan la misma carga eléctrica, es necesario formar cadenas apolares con átomos de carbono distintos y por lo menos con dos hidrógenos también distintos. Partimos del átomo de carbono en estado fundamental.
Los enlaces carbono a carbono de la cadena alifática, es un enlace covalente coordinado continuo.
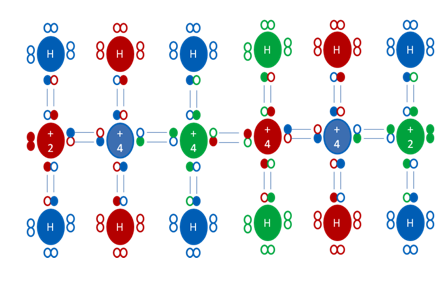
+2, +4, +4, +4, +2, representa a las diferentes cargas eléctricas de los átomos de carbono encadenados con un semejante enlace de coordinación continua, H representa a los distintos átomos de hidrógenos, los círculos pequeños y rellenos de distintos colores representan a los electrones de los respectivos átomos y los círculos pequeños y vacíos representan a los huecos.
Figura No.21.
CATENACIÓN DEL AZUFRE
El estado fundamental del átomo de azufre es semejante al estado fundamental del oxígeno antes descrito, el azufre aprovecha la presencia de las cadenas laterales para poder tener distintas cargas eléctricas anexas, haciendo cadenas atómicas a través de enlaces coordinados continuos, semejantes a las cadenas alifáticas del carbono.
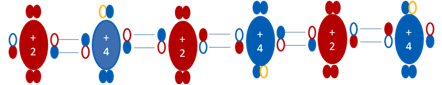
+2, +4, +2, +4, +2, son los números que representan a las diferentes cargas eléctricas de una secuencia mínima de átomos de azufre encadenados con enlaces covalentes coordinados continuos, los círculos pequeños y rellenos de los distintos colores representan a los electrones de los respectivos átomos y los círculos pequeños y vacíos representan a los huecos.
Figura No.22.
ÁTOMO de BORO en ESTADO FUNDAMENTAL y EXCITADO
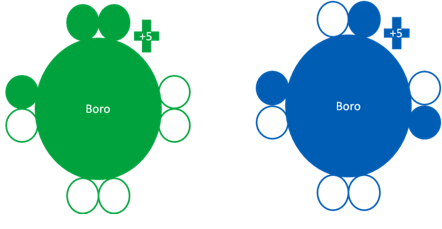
Átomos de boro donde el átomo de la izquierda corresponde a un átomo de boro en estado fundamental mientras el boro de la derecha, es un átomo de boro en estado excitado. Los pequeños círculos rellenos de verde y azul son los electrones de valencia del átomo que tenga el mismo color y los pequeños círculos vacíos son los huecos.
Fig. No.23.
ÁTOMO de CALCIO o BERILIO en ESTADO FUNDAMENTAL y EXCITADO
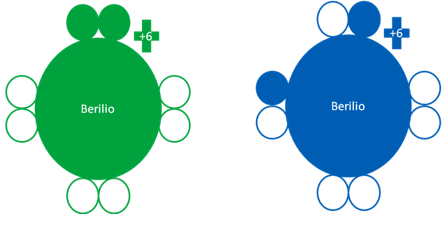
Átomos de calcio o berilio donde el átomo de la izquierda corresponde a un átomo de berilio en estado fundamental mientras el berilio de la derecha, es un átomo de calcio o berilio en estado excitado. Los pequeños círculos rellenos de verde y azul son los electrones de valencia del átomo que tenga el mismo color y los pequeños círculos vacíos son los huecos del átomo que tenga el mismo color de línea.
Fig. No.24.
ÁTOMO de LITIO en ESTADO FUNDAMENTAL y EXCITADO
Igual que el flúor el átomo de litio, el estado fundamental es idéntico el estado excitado, por eso podemos decir que son elementos que siempre están excitados.
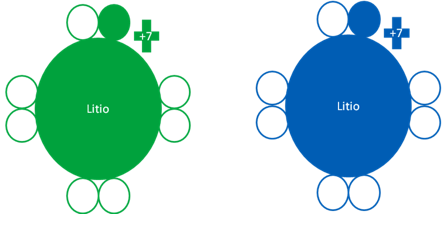
Átomos de litio donde el átomo de la izquierda corresponde a un átomo de litio fundamental mientras el litio de la derecha, es un átomo de litio en estado excitado pero son idénticos. Los pequeños círculos rellenos de verde y azul son los electrones de valencia del átomo del mismo color y los pequeños círculos vacíos son los huecos.
Fig. No.25.
3- Conclusiones:
1- LA PRIMERA ÚNICA Y GRAN CONCLUSIÓN de este artículo es que en realidad, los huecos revolucionan a la fisicoquímica, por las grandes repercusiones que tiene en la carga eléctrica de los átomos en las moléculas. Si bien es cierto que este artículo es solo teoría y que hace falta sobretodo probar en unos semiconductores propuesto en el trabajo de células fotoeléctricas. Además hay fenómenos indiscutibles, como son la identificación de dos tipos de enlaces covalentes en las moléculas hipervalentes, la descripción de los iones divalentes de plomo, etc., etc. Es probable también que el hueco como partícula, explique las anomalías en la configuración electrónica que tienen los elementos de transición.
4- Referencias
REFERENCIAS DEL ARTÍCULO.
[1] Barrera rotacional del etano.
[2] Enlaces de uno y tres electrones.
[3] Enlaces de uno y tres electrones.
[4] Origen de la barrera rotacional del etano
[5] Monóxido de Carbono
[6] Nueva regla fisicoquímica del octeto
[7] Células fotoeléctricas Monografías.
[8] Células Fotoeléctricas textoscientificos.
[9] Semiconductores Monografías.
[10]Semiconductores textoscientificos.
[11]Superconductividad.
[12]Superconductividad.
[13]Alotropía.
[14]Alotropía del Carbono.
[15]Alotropía del Oxigeno.
[16]Ozono.
[17]Diborano
[18]Semiconductores y temperatura.
REFERENCIAS DE LA TEORÍA
[1] Número cuántico magnético.
[2] Ángulo cuántico
[3] Paul Dirac y Nosotros
[4] Numero cuántico Azimutal monografias
[5] Numero cuántico Azimutal textoscientificos
[6] Inflación Cuántica textos científicos.
[7] Números cuánticos textoscientíficos.com.
[8] Inflación Cuántica Monografías
[9] Orbital Atómico
[10] Números Cuánticos.
[11] Átomo de Bohr.
[12] Líneas de Balmer.
[13] Constante Rydberg.
[14] Dilatación gravitacional del tiempo.
[15] Número Cuántico magnético.
[16] Numero Cuántico Azimutal.
Copyright © Derechos Reservados.
Heber Gabriel Pico Jiménez MD. Médico Cirujano 1985 de la Universidad de Cartagena Colombia. Investigador independiente de problemas biofísicos médicos propios de la memoria, el aprendizaje y otros entre ellos la enfermedad de Alzheimer.
Estos trabajos, que lo más probable es que estén desfasados por la poderosa magia secreta que tiene la ignorancia y la ingenuidad, sin embargo, como cualquier representante de la comunidad académica que soy, también han sido debidamente presentados sobretodo este se presentó el 27 de Agosto del 2013 en la “Academia Colombiana de Ciencias Exactas, Físicas y Naturales” ACCEFYN.