New chemical rule of byte
Heber Gabriel Pico Jiménez MD
Resumen
Explorar una regla del octeto que reconoce a los huecos el valor que se merecen al lado de los electrones, donde ambos responden por responsabilidades eléctricas ya que son los dos únicos portadores de carga y operan sus contextos en el último nivel de energía de valencia de los átomos. Desde ese punto de vista los elementos puros jamás son neutros, ya que si lo fueran serían totalmente inertes pero a través de la regla, tratan de convertirse en gases nobles porque estos sí son elementos neutrales. Con estos cambios y teniendo en cuenta el grado de repulsión y atracción que hay entre los distintos pares de electrones y huecos, la norma no solo predice las disposiciones geométricas espaciales que adoptan los átomos y las moléculas sino que además alcanza explicar a fenómenos químicos que hasta hoy son oscuros como por ejemplo: Se distinguen dos tipos estructurales distintos de enlaces covalentes de las moléculas hipervalentes, que son los que definen la estructura geométrica. Se explica el efecto Hall. Se explican las formas tetraédricas irregulares de los átomos. Se descubre una relación inversa entre la energía de ionización y la conductividad eléctrica. Se aclara el enlace sobrecordinado de hidrogeno en el agua. Se explica la manera cómo el Helio cumple la regla del octeto. Se aclara el mecanismo usado por los llamados iones atípicos divalentes de plomo, germanio y estaño. Se explica la naturaleza del enlace central del hidrógeno en el Diborano, catión de dihidrógeno y los semiconductores. Además revela la manera como los metales de transición cumplen esa nueva regla del octeto.
Palabras claves: Los gases nobles son los únicos átomos neutros.
Abstract
Explore a rule of byte that recognizes the value they deserve to the side holes of the electrons, where both responds by electric responsibilities, since they are two unique charge carriers and operate their contexts in the last level of energy of valence of atoms. From this point of view the pure elements are never neutral, because if they were they would be completely inert but through the rule, try to become noble gases because they are neutral. With these changes and taking into account the degree of repulsion and attraction between different pairs of electrons and holes, standard predicts not only the spatial geometric arrangements that adopt the atoms and molecules, but also reaches to explain chemical phenomena which until today are dark like for example: there are two different types of Covalent bonds that are causing the molecules hipervalentes geometric structure. Explain Hall Effect. The tetrahedral and irregular forms of atoms can be explained. Discovered a relationship between the energy of ionization with electrical conductivity. The link sobrecordinado is clarified of hydrogen in the water. It explains how how helium fulfills the octet rule. Clarifies the mechanism used by the so-called atypical divalent ions of lead, germanium and Tin. Explains the nature of the central link of the hydrogen in the diborane, Dihydrogen cation, and semiconductors. Also reveals the way as transition metals meet that new rule of byte.
Keywords: The noble gases are the only neutral atoms.
1. Introducción
Precisamos que todo el desarrollo de este artículo, estará siempre sostenido en el principio de que químicamente los electrones por lo general, estarán casi siempre apareados, bajo este principio se desarrollan los anteriores trabajos de energía atómica Número cuántico magnético del electrón, el trabajo de la superconductividad, el artículo del acoplamiento espín-órbita del electrón, además el anterior trabajo de Semiconductores y el de Células fotoeléctricas publicado en textoscientificos y Monografías.
2. Desarrollo del Tema.
La nueva regla del Octeto es una norma que se basa en el principio de que los portadores de carga eléctrica son los electrones y los huecos, andan siempre apareados y el objetivo de la regla es de configurar octetos en el ultimo nivel de energía de valencia en los átomos, se formaran 4 pares de electrones y huecos a su alrededor que son los dos distintos tipos de portadores de carga eléctrica. Uno de sus principios es que siempre el número de portadores de carga eléctrica de valencia de los átomos, será Par.
Al reconocerle a los huecos electrónicos como los otros portadores de carga eléctrica, el átomo puro deja de tener carga eléctrica neutra a pesar de que aun no haya reaccionado con otro átomo distinto.
Esta regla del octeto no puede ser aplicada de una manera unilateral utilizando solamente a los electrones tal como si ellos fueran los únicos que representan a la carga eléctrica elemental, también debe extender su aplicación a los portadores de carga eléctrica contraria, que serían los pares de huecos electrónicos libres que representan a las cargas eléctricas positivas en las mismas especies químicas.
Una de las estrategias que tienen los átomos, para poder cumplir la regla del octeto en su último nivel de energía, son las configuraciones de los pares de electrones libres como elementos con carga negativa y también a los pares de huecos electrónicos libres, como elementos de carga contraria y en ocasiones, el apareamiento mixto entre huecos y electrones para completar el octeto.
CARACTERISTICAS de los HUECOS ELECTRÓNICOS
Los huecos de electrones o estrictamente huecos, tal como una ausencia de electrones en la banda de valencia, no son simplemente unas características de solo aislantes y semiconductores, por el contrario son partículas móviles elementales portadoras de cargas eléctricas contrarias a la carga del electrón y presentes en casi todos los átomos incluso el helio.
Esta regla convierte a los distintos elementos puros de la tabla periódica, en portadores de carga eléctrica y que gracias a ella, los átomos están aptos para efectuar las distintas reacciones químicas y es la misma causa de que los gases nobles tengan tan bajo punto de ebullición y además, sean nobles es decir, sean inertes, por el hecho de ser los únicos que no tienen carga eléctrica.
El grupo de los halógenos tiene una carga positiva extra y podría representarse a uno de sus elementos como el flúor F1+.
El grupo de los anfígenos tienen a dos cargas positivas de más y podría representarse a uno de sus elementos como el oxígeno O2+.
El grupo del nitrógeno tiene a tres (3) cargas positivas y podría representarse a uno de sus elementos como el nitrógeno N3+.
El grupo del carbono tiene a cuatro (4) cargas positivas y podría representarse a uno de sus elementos como el carbono C4+.
El grupo del boro tiene a cinco (5) cargas positivas sobrantes y podría representarse a uno de sus elementos como el boro B5+.
El grupo del berilio y algunos elementos de transición tienen a seis (6) cargas positivas de más y podría representarse a dos de esos elementos como calcio Ca6+ y hierro Fe6+.
El grupo del hidrógeno o el grupo del litio y algunos elementos de transición tienen de sobra a siete (7) cargas positivas y podría representarse a dos de esos elementos como Li7+ y rutenio Ru7+.
Los llamados huecos electrónicos son partículas elementales constituidas por espacio cuántico vacío, a pesar de que no tienen masa están dotadas de energía del vacío, cuentan con carga eléctrica contraria a la del electrón pero tienen un momento angular como propiedad física intrínseca de las partículas subatómicas que es análoga a la masa y a la carga eléctrica.
A un par de huecos los acopla el espín de carga positiva y a un par de electrones también los acopla el espín de carga contraria, además un electrón apareado con un hueco siempre el momento angular los acopla. El espín no tiene signo ya sea de carga positiva o negativa siempre los acopla.
Los huecos electrónicos se repelen entre ellos al igual como ocurre entre electrones que lo hacen por tener la misma carga eléctrica pero se acoplan por tener espines contrarios. Los electrones se atraen con los huecos electrónicos por tener carga contraria pero no se destruyen por el espín contrario que termina acoplándolos.
GEOMETRÍA ATÓMICA
La geometría atómica o estructura atómica, se refiere a la disposición tridimensional de los pares de electrones y huecos de valencia que constituyen el último nivel de un átomo. Determina esto a muchas de las propiedades de los átomos como son la reactividad, polaridad, fase, color, magnetismo, actividad biológica etc.
La posición de cada par de electrones, par de huecos o cada par de huecos apareados con electrones, determina el enlace químico que puede formar. La geometría atómica puede describirse por las posiciones que tengan estos pares de electrones y huecos en el espacio, mencionando el tipo de par y el ángulo entre dos y tres de ellos consecutivos.
GEOMETRÍA TETRAÉDRICA e IRREGULAR del ÁTOMO
La geometría atómica al cumplir la nueva regla del octeto siempre será una geometría en la cual el átomo tendrá a cuatro pares de electrones o huecos que se encuentran en las esquinas de un tetraedro irregular. La mayoría de los átomos no poseen tan alta simetría y forman tetraedros irregulares. Los átomos pueden tener configuraciones quirales si poseen los 4 pares distintos.
La NUEVA REGLA del OCTETO en ÁTOMOS del GRUPO I de la TABLA PERIÓDICA o grupo del HIDRÓGENO
Los átomos que le pertenecen al grupo I de la tabla periódica donde se encuentra el hidrógeno y el litio, tienen a un solo electrón de valencia en su último nivel de energía para cumplir la regla del octeto, con ese único electrón esos elementos configuran a un par en estado mixto, donde el electrón está apareado con un hueco.
Además de poseer a un electrón apareado con un hueco, tienen a tres (3) pares exclusivos de huecos libres en su último nivel de energía.

Los círculos pequeños y vacios son los huecos, el único circulo pequeño y relleno es un electrón de valencia en un átomo de hidrogeno.
Figura No.1
La NUEVA REGLA del OCTETO en ÁTOMOS del GRUPO II de la TABLA PERIÓDICA o grupo del BERILIO
Los átomos que le pertenecen al grupo II de la tabla periódica tienen solo a dos (2) electrones de valencia en su último nivel de energía, en cumplimiento de la regla del octeto los dos electrones del nivel de valencia, cada uno se aparean de forma heterogénea con dos huecos distintos, formándose dos (2) pares distintos mixtos de electrones y huecos.
Además de poseer a dos electrones apareados con dos huecos distintos, tienen a dos pares exclusivos de huecos libres en su último nivel de energía.

Los círculos pequeños y vacios son los huecos, hay dos círculos pequeños y rellenos que son los 2 electrones de valencia en un átomo de calcio.
Figura No.2
La NUEVA REGLA del OCTETO en los METALES de TRANSICIÓN
La mayoría de los metales de transición tienen solo a dos electrones de valencia en su último nivel de energía pero algunos poseen a un solo electrón de valencia.
Ellos configuran su octeto igual que un alcalino o alcalinoterreo, apareando cada uno de los dos (2) electrones de valencia con un hueco distinto y si tienen a un solo electrón de valencia, pues solo a él lo aparearan con el referido hueco electrónico.
Quiere decir que algunos metales de transición tendrán a tres (3) pares de exclusivos huecos libres y otros tendrán solo a dos pares de ellos mismos.
Se hace pertinente destacar que los metales de transición con estos tres pares de exclusivos huecos libres, los hace tener múltiples estados de oxidación.
Los metales de transición a pesar de ser iguales en el último nivel a los alcalinos y alcalinotérreos, tienen la ventaja de poder variar el número de huecos y electrones en este último nivel de energía. Ellos pueden intercambiar a los huecos del último nivel por electrones d del nivel anterior.
Un metal de transición puede tener los 8 electrones de valencia de un gas noble y configurar el mismo enlace covalente tipo II o enlace covalente tipo par libre.
Se hace oportuno resaltar que los estados de oxidación más alto lo tienen el Osmio y el Rutenio y no es una casualidad de que sea de +8.
La NUEVA REGLA del OCTETO en ÁTOMOS del GRUPO 13 de la TABLA PERIÓDICA o grupo del BORO
Los átomos que le pertenecen al grupo 13 de la tabla periódica tienen a tres (3) electrones de valencia en su último nivel de energía, en cumplimiento de la regla del octeto los tres electrones del nivel de valencia, cada uno de los tres se aparea con un hueco distinto formándose entonces a tres (3) pares distintos mixtos de electrones y huecos.
Además de poseer a tres electrones apareados con tres huecos distintos, tienen a un par exclusivo de huecos libres en su último nivel de energía.

Los círculos vacios son los huecos, hay tres círculos rellenos que son los 3 electrones de valencia de un átomo de boro.
Figura No.3.
La NUEVA REGLA del OCTETO en ÁTOMOS del GRUPO 14 de la TABLA PERIÓDICA o grupo del CARBONO
Los átomos que le pertenecen al grupo 14 de la tabla periódica tienen a cuatro (4) electrones de valencia en su último nivel de energía, en cumplimiento de la regla del octeto los cuatro electrones de valencia del último nivel, como son elementos que están ubicados totalmente en el centro de la tabla periódica, tiene dos opciones para cumplir la nueva regla del octeto. Una manera sería tratar de cumplir con pares de huecos hacia la izquierda de la tabla y otra sería, cumplir con pares de electrones hacia la derecha de la misma.
La primera opción es aparear con un hueco a cada electrón y así formarían a cuatro pares distintos mixtos de electrones y huecos. Esta configuración es típica del carbono y el silicio.

Los círculos vacios son los huecos, hay cuatro círculos rellenos que son los 4 electrones de valencia de un átomo de carbono.
Figura No.4.
La segunda opción es aparear con un hueco distinto solo a dos de los cuatro electrones de valencia, para cumplir con la nueva regla del octeto se formarían así además en el mismo átomo, tanto un par exclusivo de electrones libres y un par exclusivo de huecos libres. Esta configuración acostumbra aparecer hacia abajo del grupo y es típica del germanio el estaño y el plomo incluso, no con todos los aniones porque ocurre con el oxigeno pero no con el azufre.

Los círculos vacios son los huecos, hay cuatro círculos rellenos que son los 4 electrones de valencia de un átomo de plomo.
Figura No.5.
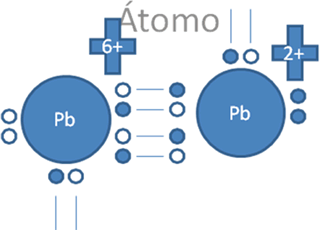
Esto explica los casos de la figura No.6 de los iones divalentes del grupo 14 de la tabla periódica de plomo, germanio y estaño, en los cuales cada uno por su lado sigue cumpliendo a su alrededor en las moléculas que forman la nueva regla del octeto, con dos pares de electrones enlazantes, un par de exclusivos electrones libres y un par de exclusivos huecos libres. La presencia de pares de huecos libres y pares de electrones libres alrededor del octeto del mismo átomo, los facultan para la formación de un triple enlace con doble enlace coordinado como lo hace el carbono.
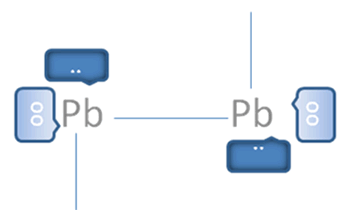
El par de punticos blancos, sólido y rodeado del marco azul oscuro corresponden al par de electrones libres, El par de círculos blancos y vacíos del marco azul claro corresponden al par de huecos electrónicos libres, Las líneas continuas representan enlaces covalentes compartidos tipo I, Pb es el símbolo de un átomo cualquiera del grupo catorce de la tabla periódica.
Figura No.6.
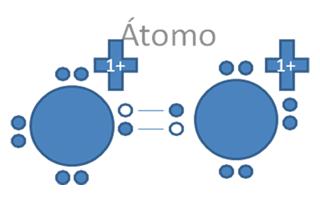
En caso de que cada par de huecos libres electrófilo ubicado en el octeto de cada átomo, sea atacado cada uno por un par de electrones libres nucleófilo ubicado en el octeto de un átomo extraño, se configura un enlace coordinado y quedarían cada átomo solo con los pares nativos de electrones libres y dejaría de ser trans como antes pero quedarían como en la siguiente Figura No. 7.
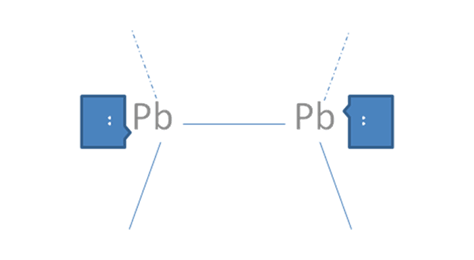
El par de punticos blancos y sólidos en el marco azul oscuro corresponden al par de electrones libres, Las líneas continuas representan enlaces covalentes compartidos, Las líneas por trazos representan a los enlaces covalentes coordinados, Pb es el símbolo de un átomo cualquiera del grupo catorce de la tabla periódica.
Figura No.7
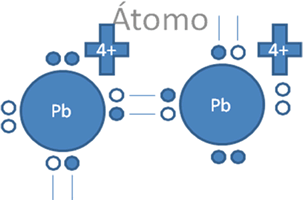
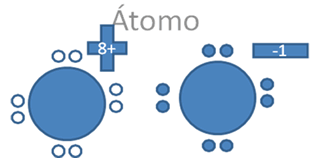
Estos iones divalentes de la figura No.6 si alcanzaran efectuar entre ellos a un solo enlace coordinado, quedarían uno de ellos con un par de electrones libres pero con carga negativa y el otro resultaría, con un par de huecos libres pero con carga positiva tal como lo sugiere la Figura No. 8.
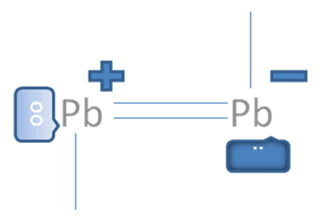
El par de punticos blancos y sólidos en el marco azul oscuro corresponden al par de electrones libres, El par de círculos blancos y vacíos en el marco azul claro corresponden al par de huecos electrónicos libres, Las líneas continuas representan enlaces covalentes, Pb es el símbolo de un átomo cualquiera del grupo catorce de la tabla periódica.
Figura No.8
Los círculos vació son los huecos, los círculos pequeños rellenos son los electrones.
Figura No.8
En esta anterior figura No.8 se observa que se puede asumir que el plomo de la derecha, aunque es positivo relativamente negativo con respecto al átomo de Pb de la izquierda.
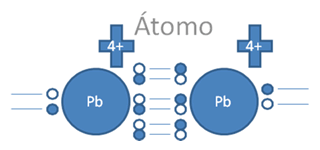
En esta anterior figura No.8 se observa que todavía existe la posibilidad de un segundo enlace coordinado que si se lleva a cabo se origina un triple enlace tal como lo ilustra la siguiente figura No.9.
![]()
Pb es el símbolo de un átomo cualquiera del grupo catorce de la tabla periódica, Las líneas continuas representan enlaces covalentes.
Figura No.9
La NUEVA REGLA del OCTETO en ÁTOMOS del GRUPO 15 de la TABLA PERIÓDICA o grupo del NITRÓGENO
Los átomos que le pertenecen al grupo 15 de la tabla periódica tienen a cinco (5) electrones de valencia en su último nivel de energía, en cumplimiento de la nueva regla del octeto los cinco electrones del nivel de valencia, como no pueden configurar pares de huecos, no cuentan con dos opciones como le sucede a los elementos del grupo 14 para cumplir la nueva regla del octeto.
La única opción que tienen es aparear solo a tres electrones de valencia con un hueco libre distinto, quedando la configuración con tres (3) pares mixtos de electrones y huecos y un solo par de exclusivos electrones libres.

Los círculos vacios son los huecos, hay cinco círculos rellenos que son los 5 electrones de valencia en un átomo de nitrógeno.
Figura No.10.
La NUEVA REGLA del OCTETO en ÁTOMOS del GRUPO 16 de la TABLA PARIÓDICA o grupo del OXÍGENO
Los átomos que le pertenecen al grupo 16 de la tabla periódica tienen a seis (6) electrones de valencia en su último nivel de energía, en cumplimiento de la nueva regla del octeto de los seis electrones del nivel de valencia, tampoco cuentan con dos opciones como le sucede al grupo 14 para cumplir la nueva regla del octeto.
La única opción es aparear solo a dos (2) de los electrones, del total de 6 electrones de valencia, de esos dos aparea a cada electrón con un hueco libre distinto, quedando la configuración con dos (2) pares mixtos de electrones y huecos y dos (2) pares de exclusivos electrones libres.

Los círculos vacios son los huecos, hay seis círculos rellenos que son los 6 electrones de valencia en un átomo de oxígeno.
Figura No.11.
La NUEVA REGLA del OCTETO en ÁTOMOS del GRUPO 17 de la TABLA PERIÓDICA o grupo del FLÚOR
Los átomos que le pertenecen al grupo 17 de la tabla periódica tienen a siete (7) electrones de valencia en su último nivel de energía, en cumplimiento de la nueva regla del octeto los siete electrones del nivel de valencia, no tienen varias opciones como le sucede al grupo 14 para cumplir la nueva regla del octeto.
La única opción es aparear solo a un (1) electrón de los 6 electrones de valencia, aparearlo con un hueco libre, quedando la configuración con un (1) solo par mixto de electrones y huecos y tres (3) pares formado por exclusivos electrones libres.

Los círculos vacios son los huecos, hay siete círculos rellenos que son los 7 electrones de valencia en un átomo de flúor.
Figura No.12.
La NUEVA REGLA del OCTETO en ÁTOMOS del GRUPO 18 o GASES NOBLES o grupo del HELIO
El cabeza de este grupo es el átomo de Helio quien cumple la nueva regla del octeto configurando a un par de electrones libres, que deben diferenciarse de que no son iguales a un par de electrones enlazantes y además, queda con tres pares de exclusivos huecos libres. El Helio es un elemento atómico más no es una molécula.
La diferencia que guarda la configuración del helio enfrente de la del hidrógeno y el hidruro, es que el helio no tiene el par mixto del átomo de hidrógeno está constituido por el electrón de valencia apareado con un hueco. En el ión hidruro se configura es un par enlazante más no se trata de un par libre como el que aparece en el Helio.
A partir del segundo representante del grupo de los gases nobles que es el Neón, se configuran a cuatro pares de electrones libres más no son 4 pares de electrones enlazantes.
Cundo el hidrogeno adquiere a un par de electrones enlazantes en el ultimo nivel de energía, se convierte en un ión hidruro.

Hay ocho círculos rellenos que son los 8 electrones de valencia en un átomo de neón.
Figura No.13.
El átomo de helio tiene a un par de electrones libres y a 3 pares de huecos libres.
A pesar de que es un elemento que no se encuentra en estado neutro, ya que tiene a 3 pares de huecos, el par de electrones libres alcanza neutralizar por el grado de atracción que ejerce sobre los 3 pares de huecos.

Los círculos vacios son los huecos, hay dos círculos rellenos que son los 2 electrones de valencia en un átomo de helio.
Figura No.14.
REPULSIÓN y ATRACCIÓN entre PARES de ELECTRONES y PARES de HUECOS LIBRES en los ÁTOMOS PUROS
Entonces así como la teoría TRePEV alcanzó a identificar en una molécula, la repulsión electrostática que hay entre los diferentes pares de electrones pues también, el átomo neutro alcanza adoptar una disposición espacial o geometría atómica que trata de minimizar, no solo al grado de repulsión sino también de sobrellevar a la vez el ímpetu de la atracción que se presenta entre los pares de huecos y los pares electrones libres exclusivos y mixtos alrededor de un átomo en estado neutral. Habrá un grado de repulsión entre los distintos pares de huecos libres, también habrá otro valor de la intensidad de repulsión o atracción entre los pares de huecos mixtos y habrá un grado solo de atracción entre los pares de huecos libres con los pares de electrones libres.
Por ejemplo en el átomo de helio con un solo par de electrones libres, que no debe confundirse con un par de electrones enlazantes porque el átomo de helio es totalmente neutro, este par de electrones libres en el átomo de helio, no encuentra contraposición que le impida ejercer a toda su fuerza de atracción en contra de los tres pares de huecos libres.
Cosa distinta sucede por ejemplo en un átomo neutro como el hidrógeno, que a pesar de que tiene los mismos tres (3) pares de huecos libres del helio, sin embargo, el par donde se ubica el electrón, es un par mixto, ya que está constituido por un electrón y un hueco a quien la fuerza de atracción, no le alcanzan para silenciar a los 3 pares de huecos libres.
Cuando el par de electrones es enlazante el átomo neutro de hidrogeno se convierte en ión. Este par de electrones enlazantes ejerce menor fuerza de atracción sobre los dos pares más cercanos de huecos libres, silencia a dos pares de ellos pero queda libre un solo par de huecos que es el responsables del enlace por puente de hidrogeno incluso, a veces solo le alcanzan las fuerzas para atraer no más que a un solo par, dejando libre a un par adicional de hueco, que es el responsables del enlace sobrecoordinado de hidrógeno en la molécula de agua.
ENLACE por PUENTE de HIDRÓGENO según la NUEVA REGLA del OCTETO
Cuando un átomo de hidrógeno estable un enlace covalente con otro átomo electronegativo, al cumplir la regla del octeto la molécula entre los dos átomos, el hidrógeno configura 3 pares de huecos libres y un solo par de electrones enlazantes. Si el enlace es iónico el hidrogeno suelta su electrón y se convierte en un ión de 4 pares de huecos, 3 de ellos serían pares de huecos libres y un solo par de huecos son huecos enlazantes. Bien, nos interesa en este tema del puente de hidrógeno es al hidrógeno haciendo un enlace covalente. El par de electrones enlazantes, atrae y opaca lateralmente a dos de los pares de huecos libres y por repulsión el hueco libre central del hidrogeno, se aparta totalmente en la misma dirección del par enlazante pero con sentido contrario, este par de huecos de dirección contraria es quien efectúa generalmente el puente de hidrógeno, que es un enlace que comparte los electrones libres de otro átomo también electronegativo. En muchos casos el par de electrones enlazantes estereoquímicamente no alcanza opacar, a uno de los pares de huecos libres laterales del hidrógeno, entonces se pueden expresar haciendo puentes de hidrogeno adicionales o sobrecoordinados.
RAZONES para la FORMACIÓN de moléculas HIPERVALENTES según la NUEVA regla del OCTETO
Las moléculas hipervalentes surgen cuando un halógeno rompe a los pares libres de otro elemento. El átomo que dentro los halógenos ostenta la mayor fortaleza para romper pares libres de electrones es el Flúor, después le sigue el cloro y después el oxigeno.
Por ejemplo el pentacloruro de fósforo se prepara en una reacción equilibrada en un 40% reversible a 180 ºC por cloración del tricloruro de fósforo. Una molécula de cloro rompe el par libre que tiene el átomo de fósforo en la molécula de tricloruro de fósforo.
En el pentacloruro de fósforo tiene configurados a los dos distintos tipos de enlaces covalentes existentes. Los 3 enlaces covalentes que tiene configurado inicialmente el tricloruro de fosforo, son enlaces de pares mixtos en el fósforo y son distintos a los dos enlaces covalentes que se forman adicionalmente cuando el cloro rompe al par libre del fósforo.
El hexafluoruro de azufre también configura a los dos tipos distintos de enlaces covalentes y se sintetiza a partir de la exposición directa del azufre (S8) y el flúor gaseoso (F2) a 300 ºC. Aquí un átomo de Flúor rompe a dos pares libres que tiene el átomo de azufre. En esta molécula los dos enlaces axiales corresponden a los pares mixtos del azufre mientras que los otros cuatro enlaces ecuatoriales se originan por la ruptura de dos pares de electrones libres.
El trifluoruro de cloro se prepara por fluoración directa del cloro a 180 ºC. Aquí un átomo de flúor a pesar de que el cloro es un también un halógeno, el flúor rompe por lo menos a uno de los 3 pares libres del cloro. Esta molécula también tiene configurados a los dos tipos distintos de enlaces covalentes. Uno de los enlaces lo forma el único par mixto del cloro.
En los compuestos organosulfurados es el átomo de oxigeno quien le rompe los dos pares libres del azufre.
RAZONES para FORMACIÓN de moléculas HIPOVALENTES según la NUEVA REGLA del OCTETO
Las moléculas hipovalentes surgen cuando un átomo como el hidrogeno, rompe al par libres de huecos que tiene otro átomo distinto.
El diborano se forma porque el hidrogeno, rompe al par de huecos libres en el borano BH3, que es el hidruro de boro más simple conocido, para formar al ión borohidruro [BH4]- quien al final forma al diborano.
ENLACE COVALENTE TIPO I o enlace TIPO MIXTO-MIXTO
El enlace químico de un halógeno con otro halógeno, tal como se ilustra en la siguiente figura:
Los círculos vacios son los huecos, hay ocho (8) círculos rellenos que son los 7 electrones de valencia en un átomo del halógeno con otro halógeno.
Figura No.15.
Vemos que cada uno de los dos átomos tiene a un electrón apareado de forma mixta con un hueco por lo tanto, ese par de átomos puede configurar un enlace covalente tal como lo sugiere la anterior figura. Este enlace tiene las caracteristicas es entre un par de electrones y huecos que da la imperón de ser un enlace doble pero en realidad es un enlace covalente simple tipo I o enlace tipo Mixto-Mixto. Otra caracteristica que tiene este eenlace es que no altera el valor de la carga eléctrica de los átomos donde él interviene.
ENLACE IÓNICO
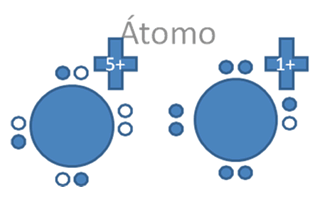
El enlace iónico, conformado por un halógeno y el hidrógeno, traspasando el hueco del halógeno al átomo alcalino en compensación del electrón que recibe, quedaría el alcalino con carga positiva y 4 pares de huecos mientras el halógeno queda con carga negativa y 4 pares de electrones:
Los círculos vacios son los huecos, hay ocho (8) círculos rellenos que son los 7 electrones del halógeno y uno del alcalino pero todos los tiene el halógeno.
Figura No.16.
Se forman dos iones uno es un catión libre alcalino y el otro es un anión libre de halógeno. El enlace iónico altera la carga eléctrica de los átomos que intervienen en el enlace
ENLACE COORDINADO
En el enlace coordinado el par de electrones es de un halógeno por ejemplo y el par de huecos, son del boro también por ejemplo en la siguiente figura y se configura un enlace covalente de tipo I:
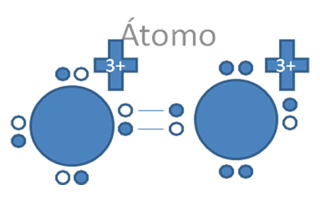
Los círculos vacios son los huecos, hay ocho (8) círculos rellenos que son los 7 electrones de valencia del halógeno y uno del alcalino.
Figura No.17.
El enlace cordinado si altera el valor de la carga eléctrica de los átomos que intervienen en el enlace.
ENLACE COVALENTE TIPO II o TIPO PAR LIBRE
Es aquel enlace que se configura entre uno de los electrones enlazantes de un par mixto de un halógeno como el flúor y el par de electrones libres de un anfígeno por ejemplo el azufre:
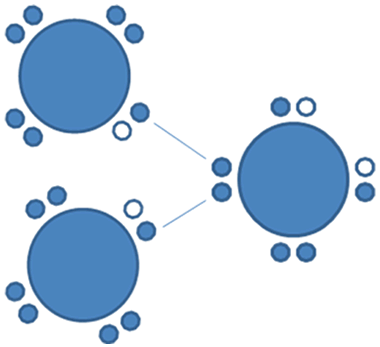
Los círculos vacios son los huecos, hay 21 círculos rellenos que son los electrones de valencia de dos halógenos y un anfígeno.
Figura No.18.
El enlace covalente tipo par libre es un enlace de mayor longitud o sea es un enlace menos fuerte que el enlace covalente tipo I o enlace mixto-mixto. Hay que resaltar que el enlace covalente tipo II o par libre, no altera la carga electrica de los átomos que intervienen en el enlace.
DOPAJES en SEMICONDUCTORES
Cuando un átomo no neutral como el fósforo, se incorpora dopando a un semiconductor puro como el silicio en el dopaje tipo N, este elemento dopante que pertenece al grupo donde los átomos tienen una carga neta positiva P3+, cuando el átomo de fósforo se enlaza con el silicio jamás pierde ni gana electrones, tampoco pierde ni gana huecos, porque todos hacen parte de su octeto particular.
Por otro lado cuando un átomo no neutral como el boro, se incorpora dopando a un semiconductor como el silicio en el dopaje tipo P, este elemento dopante que pertenece al grupo donde los átomos tienen una carga neta positiva B5+, cuando el átomo de boro se enlaza con el silicio jamás pierde ni gana electrones, tampoco gana ni pierde huecos porque todos hacen parte de su octeto particular.
Los dos dopajes tipo N y P descritos en los párrafos inmediatamente anteriores, hacen un campo electrostático donde un polo estária conformado por el nitrógeno N3+ y el otro polo por el fósforo P5+ por lo tanto esta diferencia de potencial ocasiona el flujo compensatorio de un par de electrones desde el dopaje tipo N hacia el dopaje tipo P.
CONDUCTIVIDAD ELÉCTRICA
Para que un átomo sea en alguna medida un conductor eléctrico, solo necesita tener electrones apareados con huecos, algo distinto es tener que calificarlo como un buen o mal conductor eléctrico.
Los pares conformados por electrones y huecos, son atraídos con menor intensidad por el núcleo de un átomo, con respecto a los pares constituidos de exclusivos electrones.
Los gases nobles no tienen electrones apareados con huecos tal como el helio y demás gases nobles, entonces no solo es un gas noble, además de tener la más alta energía de ionización también es un conductor noble.
A pesar de que los halógenos o grupo 17 de la tabla periódica con el grupo I y algunos elementos de transición, a pesar de que ellos tienen todos a un solo electrón apareado de forma mixta con un hueco, a pesar de esa igualdad los elementos del grupo I y algunos elementos de transición como la plata, el cobre y el oro, con ese solo par mixto les basta para ser un buen conductor eléctrico, pero eso se lo deben a la poca energía de ionización porque resulta que los halógenos, tienen una contundente energía de ionización cuestión que les impide ser buenos conductores eléctricos, incluso es la más alta de la tabla periódica después de los gases nobles, entonces tras esto presenta una conductividad eléctrica mínima. Los elementos del grupo I y algunos elementos de transición si tienen igualmente a un solo par mixto igual que los halógenos, se diferencian en que ostentan los índices más bajos de energía de ionización que los faculta para tener la mayor conductividad eléctrica.
A pesar de que el grupo 16 de la tabla periódica o grupo del oxígeno, el grupo II o del berilio y algunos elementos de transición, a pesar de que todos ellos cuentan con dos pares de electrones apareados de forma mixta con huecos, a pesar de esa igualdad se diferencian en que los elementos del grupo II y algunos metales de transición tienen menor energía de ionización que los del grupo del oxigeno, por lo tanto tienen mayor conductividad eléctrica.
A pesar de que el grupo del nitrógeno o grupo 15 de la tabla periódica tiene tres pares mixtos de electrones y huecos que son el mismo número de pares mixtos del grupo 13 o grupo del boro, a pesar de eso este ultimo o grupo del boro, como cuenta con menor energía de ionización pues generalmente tiene mayor conductividad eléctrica que el grupo del nitrógeno.
El grupo 14 del carbono y el silicio que está ubicado en el centro de la tabla periódica, tienen 4 pares mixtos de electrones y huecos pero también pueden configurar solo a dos pares, además tiene la mitad de la energía de ionización.
3- Conclusiones:
1- LA PRIMERA Y ÚNICA GRAN CONCLUSIÓN de este artículo es que en realidad, los huecos revolucionan a la físicoquímica, por las grandes repercusiones que tiene en la carga eléctrica de los átomos en las moléculas. Si bien es cierto que este artículo es solo teoría y que hace falta sobretodo probar en unos semiconductores propuesto en el trabajo de células fotoeléctricas. Además hay fenómenos indiscutibles, como son la identificación de dos tipos de enlaces covalentes en las moléculas hipervalentes, la descripción de los iónes divalentes de plomo, etc, etc. Es probable también que el hueco como partícula, explique las anomalías en la configuración electrónica que tienen los elementos de transición.
4- Referencias
REFERENCIAS DEL ARTÍCULO.
[2] Células fotoeléctricas Monografías.
[2] Células Fotoeléctricas textoscientificos.
[3] Semiconductores Monografías.
[4] Semiconductores textoscientificos.
[5] Superconductividad.
[6] Superconductividad.
[7] Alotropía.
[8] Alotropía del Carbono.
[9] Alotropía del Oxigeno.
[10]Ozono.
[11]Diborano
[12]Semiconductores y temperatura.
REFERENCIAS DE LA TEORÍA
[1] Número cuántico magnético.
[2] Ángulo cuántico
[3] Paul Dirac y Nosotros
[4] Numero cuántico Azimutal monografias
[5] Numero cuántico Azimutal textoscientificos
[6] Inflación Cuántica textos científicos.
[7] Números cuánticos textoscientíficos.com.
[8] Inflación Cuántica Monografías
[9] Orbital Atómico
[10] Números Cuánticos.
[11] Átomo de Bohr.
[12] Líneas de Balmer.
[13] Constante Rydberg.
[14] Dilatación gravitacional del tiempo.
[15] Número Cuántico magnético.
[16] Numero Cuántico Azimutal.
Copyright © Derechos Reservados.
Heber Gabriel Pico Jiménez MD. Médico Cirujano 1985 de la Universidad de Cartagena Colombia. Investigador independiente de problemas biofísicos médicos propios de la memoria, el aprendizaje y otros entre ellos la enfermedad de Alzheimer.
Estos trabajos, que lo más probable es que estén desfasados por la poderosa magia secreta que tiene la ignorancia y la ingenuidad, sin embargo, como cualquier representante de la comunidad académica que soy, también han sido debidamente presentados sobretodo este se presentó el 30 de Junio del 2013 en la “Academia Colombiana de Ciencias Exactas, Físicas y Naturales” ACCEFYN.