Abnormalities of electronic configuration
Por Heber Gabriel Pico
Resumen
Gracias a la nueva regla del octeto, se logra reconocer los intensos efectos que ejerce la regla de Hund sobre el principio de Madelung en el relleno de los niveles de energía distintos al subnivel que se viene llenando, este reconocimiento ayuda la explicación de cada una de las anomalías en la configuración electrónica. Este artículo justifica la regla de máxima multiplicidad de Hund, de acuerdo al grado de acercamiento espacial que existe entre los distintos llenados en orbitales de diferentes niveles de energía en el átomo. Al llenarse los orbitales en un subnivel de energía como los 3 orbitales p, los 5 orbitales d o los 7 orbitales f, los electrones en algunos átomos se irán distribuyendo de forma progresiva y ordenada siempre que sea posible, con sus espines paralelos, inicialmente sin importar la orientación que tengan los espines electrónicos en el subsiguiente nivel de energía que en la mayoría de los casos es el subnivel s pero en otras es el subnivel d, esta libertad del espín es permitida solo hasta cierta distancia de cercanía que se presente entre el subnivel que se vienen llenando con el subsiguiente nivel atómico. La configuración de mayor estabilidad es cuando están presentes los dos niveles con espines paralelos. Decimos algunos elementos porque esto es cierto solo para los subniveles d y p que se vienen llenando pero que no están ubicados después de los lantánidos o actínidos como es el caso del platino, porque en ese caso se cumple es la regla de Hund contraria es decir: comienzan a llenarse los orbitales pero primero en forma apareada, sin importar el espín subsiguiente ordenadamente se van llenando hasta llegar acercarse en el llenado del tercer orbital del subnivel d, momento en que la cercanía con el s subsiguiente ocasiona inversamente a un “Hund modificado” por ejemplo en el platino. Este trabajo con la regla de Hund extendida al siguiente nivel, también explica la ionización en los metales de transición.
Palabras claves: Configuración electrónica, Regla de Hund, Tabla Periódica, Huecos.
Abstract
Thanks to the new rule of byte, he is achieved by recognizing the intense effects that exerts the Hund on the principle of Madelung rule in the filling of the different levels of power to the sublevel is filled, this recognition helps the explanation of each one of the anomalies of the electronic configuration. This article correlates the rule of maximum multiplicity of Hund, according to the degree of spatial approach that exists between the different fillings in different levels of energy in the atom orbital. To fill the energy as a sub-layer orbital: 3 p orbital, orbital 5(d) or the 7 f orbital electrons in some atoms will be routed progressive and orderly whenever possible, with its parallel spins, regardless of orientation that have the electronic spins in the subsequent level of energy which in most cases is the sublevel s, but in others is the d sublevel, this freedom of spin is permitted up to a distance of closeness that comes between the sublevel come filled with the subsequent atomic level. We say some elements because this is true only for d sublevels and p that are filling but are not located after the f sublevel as it is the case of Platinum, because in that case it is the contrary Hund rule is: they begin to fill the orbital but in paired form, regardless of the subsequent spin an orderly will fill up approaching the third orbital of the d sublevel, moment in which the proximity with the subsequent s causes a "reverse Hund" for example in Platinum. This work explains the apparent paradox in the ionization of the transition elements with Hund's rule.
Keywords: Electronic Configuration, Rule Hund, Periodic Table, Holes.
1. Introducción
Precisamos que la introducción de todos estos artículos son iguales, debido que el objetivo es sostener la nueva regla del octeto. Es la misma introducción de los dos últimos artículos referidos a la configuración electrónica y la posición del hidrógeno en la nueva tabla periódica.
2. Desarrollo del Tema.
El estudio de la estructura del universo a gran escala acepta que la energía oscura, es una forma de materia que estaría presente en todo el espacio, produciendo una fuerza gravitacional repulsiva.
La energía oscura se relaciona además con la constante cosmológica quien se piensa también que se origina en la energía del vacío.
La energía del vacío es una clase de energía del punto cero, existente en el espacio incluso en ausencia de todo tipo de materia. La energía del vacío tiene un origen puramente cuántico y participa en todos los fenómenos observables.
Partimos de la reconocida configuración electrónica que rige el Principio de Construcción en el Diagrama de Moeller.
La nueva regla del octeto no aplica este principio solo para el número máximo de electrones, no, no señor, ellas son aplicadas para dos tipos de partículas que involucra tanto a los electrones y a los huecos.
Si partimos describiendo la configuración electrónica que siempre ha sido tradicionalmente aceptada descrita de la siguiente manera:
1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p6-7s25f146d107p68s25g186f147d108p69s26g187f148d109p6.
Pero la ordenamos por períodos o niveles energéticos y queda de la siguiente forma, que es precisamente la misma estructura de la nueva tabla periódica que proponemos.
1s2.
2s22p6.
3s23p6.
4s23d104p6.
5s24d105p6.
6s24f145d106p6.
7s25f146d107p6.
8s25g186f147d108p6.
9s26g187f148d109p6.
Esta notación anterior donde los exponentes son de color negro y representan a tanto a electrones y a los huecos.
Hemos ampliado la configuración electrónica hasta el noveno nivel de energía, con el fin de ilustrar reglamentada la condición de que el último nivel de energía, siempre estará ocupado por 8 partículas que incluyen a electrones y a huecos en dos subniveles, también es una regla de que el respectivo orden de llenado de las partículas en los distintos subniveles es el siguiente:
El subnivel d siempre aparecerá lleno de partículas en el nivel que es anterior al último nivel de energía.
Mientras que el subnivel f sin embargo hará su aparición en el nivel trans-anterior al último.
En ese orden de aparición el subnivel g por su parte, solo existirá lleno de partículas en el nivel tras-trans-anterior.
Decimos llenos de partículas porque nos referimos a electrones o a huecos.
Aunque lentamente a medida que se va incrementando el número atómico, los huecos van siendo reemplazados por los electrones de izquierda a derecha pero generalmente de manera inversa es decir, los electrones reemplazaran sino hay más subniveles generalmente primero a los huecos de menor energía que serían los huecos g, fy finalmente por ultimo a los huecos d que serían los huecos con energía más cercana al último nivel.

Distribución electrónica como una calcomanía de la nueva tabla periódica. Vemos que primero se reemplazan los huecos de subniveles menor energía que serían los subniveles g en la tabla, después seguirán los f y finalmente los d que es el subnivel que tiene la cantidad de energía más cercana al valor de la energía que tiene el último nivel de energía.
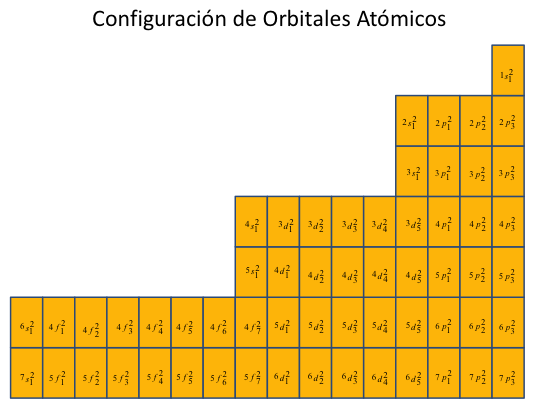
Figura No.8
CONFIGURACIÓN DE ORBITALES ATÓMICOS
Esta configuración anterior es una ordenación solo de niveles y subniveles de energías, pero para poder involucrar a los huecos en la distribución, se hace necesario describir es precisamente al tercer y cuarto número cuántico en el orbital atómico, es por eso que hacemos la siguiente configuración de orbitales.
Sabemos que para cada subnivel de energía, hay un número de 2l+1 orbitales posibles por lo tanto, el subnivel s tiene un solo orbital, el p tiene 3 y así sucesivamente. También se logra incluir en la descripción, que un orbital atómico siempre tendrá a las partículas (ya sean electrones o huecos) cumpliendo siempre un apareamiento con el principio de exclusión de Pauli.
1s2.
2s22p122p222p32.
3s23p123p223p32.
4s23d123d223d323d423d524p124p224p32.
5s24d124d224d324d424d525p125p225p32.
6s24f124f224f324f424f524f624f725d125d225d325d425d526p126p226p32.
7s25f125f225f325f425f525f625f726d126d226d326d426d527p127p227p32.
CONFIGURACION DE ELECTRONES Y HUECOS EN EL HIDRÓGENO.
El hidrógeno tiene su único orbital ocupado por un electrón que es de valencia y está identificado por el exponente de color azul en el subnivel s y está apareado con un hueco, identificado ese hueco, con el exponente de color rojo.
1s1-1
CONFIGURACIÓN DE ELECTRONES Y HUECOS EN EL HELIO
El helio igual que el hidrógeno, tiene un único orbital pero no tiene huecos. Tiene dos electrones de valencia identificados con exponentes de color azul apareados en el único orbital s.
1s1-1 o 1s2
CONFIGURACIÓN DE ELECTRONES Y HUECOS EN EL LITIO
El litio tiene un solo electrón de primera valencia identificados con exponentes de color azul y 7 huecos de primera valencia identificados con exponentes de color rojo cobijados en sus 5 orbitales atómicos, 2 electrones habitan el primer nivel energético y un electrón s en el segundo nivel de energía, además los 3 orbitales p del segundo nivel están ocupados por 6 huecos. [He]2s1-12p1-32.
[He]
2s1-12p122p222p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL BERILIO
El berilio tiene a 2 electrones de primera valencia y 6 huecos también de primera valencia [He]2s22p1-32 distribuidos de la siguiente manera:
[He]
2s22p122p222p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL BORO
El boro tiene a 3 electrones de primera valencia y 5 huecos también de primera valencia [He]2s22p11-12p2-32 distribuidos de la siguiente manera:
[He]
2s22p11-12p222p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL CARBONO
El carbono tiene a 4 electrones de primera valencia y a 4 huecos también de primera valencia [He]2s22p1-21-12p32 distribuidos de la siguiente manera.
[He]
2s22p11-12p21-12p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL NITRÓGENO
El nitrógeno tiene a 5 electrones de primera valencia y 3 huecos también de primera valencia [He]2s22p1-31-1 distribuidos de la siguiente manera:
[He]
2s22p11-12p21-12p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL OXÍGENO
El oxígeno tiene a 6 electrones de primera valencia valencia y 2 huecos también de primera valencia [He]2s22p122p2-31-1 distribuidos de la siguiente manera:
[He]
2s22p122p21-12p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL FLÚOR
El flúor tiene 7 electrones de primera valencia y un solo hueco también de primera valencia [He]2s22p1-222p31-1 distribuidos de la siguiente manera:
[He]
2s22p122p222p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL NEÓN
El neón tiene 8 electrones de primera valencia además sin huecos [He]2s22p1-32 distribuidos de la siguiente manera:
[He]
2s22p122p222p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL SODIO
El sodio tiene 1 solo electrón de segunda valencia y 7 huecos también de segunda valencia [Ne]3s1-13p1-32 distribuidos de la siguiente manera:
[Ne]
3s1-13p123p223p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL MAGNESIO
El magnesio tiene 2 electrones de segunda valencia y 6 huecos también de segunda valencia [Ne]3s23p1-32 distribuidos de la siguiente manera:
[Ne]
3s23p123p223p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ALUMINIO
El aluminio tiene 3 electrones de segunda valencia y 5 huecos también de segunda valencia [Ne]3s23p11-13p2-32 distribuidos de la siguiente manera:
[Ne]
3s23p11-13p223p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL SILICIO
El silicio tiene a 4 electrones de segunda valencia y 4 huecos también de segunda valencia [Ne]3s23p1-21-13p32 distribuidos de la siguiente manera:
1s2
2s22p122p222p32
3s23p11-13p21-13p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL FÓSFORO
El fósforo tiene 5 electrones de segunda valencia y 3 huecos también de segunda valencia [Ne]3s23p1-31-1 distribuidos de la siguiente manera:
[Ne]
3s23p11-13p21-13p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL AZUFRE
El azufre tiene a 6 electrones de segunda valencia y 2 huecos también de segunda valencia [Ne]3s23p123p2-31-1 distribuidos de la siguiente manera:
[Ne]
3s23p123p21-13p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL CLORO
El cloro tiene 7 electrones de segunda valencia y un solo hueco también de segunda valencia [Ne]3s23p1-223p31-1 distribuidos de la siguiente manera:
[Ne]
3s23p123p223p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ARGÓN
El argón tiene 8 electrones de segunda valencia totalmente sin huecos [Ne]3s23p1-32 distribuidos de la siguiente manera:
[Ne]
3s23p123p223p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL POTASIO
El potasio tiene 1 electrón y 17 huecos en la primera valencia [Ar]3d1-524s1-14p1-32 distribuidos de la siguiente manera:
1s2
2s22p122p222p32
3s23p123p223p323d123d223d323d423d52
4s1-14p124p224p32
[He]
2s22p122p222p32
3s23p123p223p323d123d223d323d423d52
4s1-14p124p224p32
[Ne]
3s23p123p223p323d123d223d323d423d52
4s1-14p124p224p32
[Ar]3d123d223d323d423d52
4s1-14p124p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL CALCIO
El calcio tiene 2 electrones y 16 huecos de primera valencia [Ar]3d1-524s24p1-32distribuidos de la siguiente manera:
[Ar]3d123d223d323d423d52
4s24p124p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ESCANDIO
El escandio tiene 3 electrones y 15 huecos de primera valencia [Ar]3d11-13d2-524s24p1-32 distribuidos de la siguiente manera:
[Ar]3d11-13d223d323d423d52
4s24p124p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL TITANIO
El titanio tiene 4 electrones y 14 huecos de primera valencia [Ar]3d1-21-13d3-524s24p1-32 distribuidos de la siguiente manera:
[Ar]3d11-13d21-13d323d423d52
4s24p124p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL VANADIO
El vanadio tiene 5 electrones y 13 huecos de primera valencia [Ar]3d1-31-13d4-524s24p1-32 distribuidos de la siguiente manera:
[Ar]3d11-13d21-13d31-13d423d52
4s24p124p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL CROMO
El cromo tiene 6 electrones y 12 huecos de primera valencia [Ar]3d1-51-14s1-14p1-32 distribuidos de la siguiente manera:
[Ar]3d11-13d21-13d31-13d41-13d51-1
4s1-14p124p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL MANGANESO
El manganeso tiene 7 electrones y 11 huecos de primera valencia [Ar]3d1-51-14s24p1-32 distribuidos de la siguiente manera:
[Ar]3d11-13d21-13d 31-13d41-13d51-1
4s24p124p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL HIERRO
El hierro tiene 8 electrones y 10 huecos de primera valencia [Ar]3d123d2-51-14s24p1-32 distribuidos de la siguiente manera:
[Ar]3d123d21-13d31-13d41-13d51-1
4s24p124p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL COBALTO
El cobalto tiene 9 electrones y 9 huecos de primera valencia [Ar]3d1-223d3-51-14s24p1-32 distribuidos de la siguiente manera:
[Ar]3d123d223d31-13d41-13d51-1
4s24p124p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL NIQUEL
El níquel tiene 10 electrones y 8 huecos de primera valencia [Ar]3d1-323d4-51-14s24p1-32 distribuidos de la siguiente manera:
[Ar]3d123d223d323d41-13d51-1
4s24p124p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL COBRE
El cobre tiene a 11 electrones y 7 huecos de primera valencia [Ar]3d1-524s1-14p1-32 distribuidos de la siguiente manera:
[Ar]3d123d223d323d423d52
4s1-14p124p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ZINC
El cinc tiene 12 electrones y 6 huecos de primera valencia [Ar]3d1-524s24p1-32 distribuidos de la siguiente manera:
[Ar]3d123d223d323d423d52
4s24p124p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL GALIO
El galio tiene 13 electrones y 5 huecos de primera valencia [Ar]3d1-524s24p11-14p2-32 distribuidos de la siguiente manera:
[Ar]3d123d223d323d423d52
4s24p11-14p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL GERMANIO
El germanio tiene 14 electrones y 4 huecos de primera valencia [Ar]3d1-524s24p1-21-14p32 distribuidos de la siguiente manera:
[Ar]3d123d223d323d423d52
4s24p11-14p21-14p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ARSÉNICO
El arsénico tiene 15 electrones y 3 huecos de primera valencia [Ar]3d1-524s24p1-31-1 distribuidos de la siguiente manera:
[Ar]3d123d223d323d423d52
4s24p11-14p21-14p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL SELENIO
El selenio tiene 16 electrones y 2 huecos de primera valencia [Ar]3d1-524s24p124p2-31-1 distribuidos de la siguiente manera:
[Ar]3d123d223d323d423d52
4s24p124p21-14p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL BROMO
El bromo tiene 17 electrones y un solo hueco de primera valencia [Ar]3d1-524s24p1-224p31-1 distribuidos de la siguiente manera:
[Ar]3d123d223d323d423d52
4s24p124p224p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL KRIPTÓN
El kriptón tiene 18 electrones y no tiene huecos en la primera valencia [Ar]3d1-524s24p1-32 distribuidos de la siguiente manera:
[Ar]3d123d223d323d423d52
4s24p124p224p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL RUBIDIO
El rubidio tiene un solo electrón y 17 huecos de segunda valencia [Kr]4d1-525s1-15p1-32 distribuidos de la siguiente manera:
[Kr]4d124d224d324d424d52
5s1-15p125p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ESTRONCIO
El estroncio tiene 2 electrones y 16 huecos de segunda valencia [Kr]4d1-525s25p1-32 distribuidos de la siguiente manera:
[Kr]4d124d224d324d424d52
5s25p125p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL YTRIO
El Itrio tiene 3 electrones y 15 huecos de segunda valencia [Kr]4d11-14d2-525s25p1-32 distribuidos de la siguiente manera:
[Kr]4d11-14d224d324d424d52
5s25p125p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL CIRCONIO
El circonio tiene 4 electrones y 14 huecos de segunda valencia [Kr]4d1-21-14d3-525s25p1-32 distribuidos en los orbitales de la siguiente manera:
[Kr]4d11-14d21-14d324d424d52
5s25p125p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL NIOBIO
El niobio tiene 5 electrones y 13 huecos de segunda valencia [Kr]4d1-41-14d525s1-15p1-32 distribuidos en los orbitales de la siguiente manera:
[Kr]4d11-14d21-14d31-14d41-14d52
5s1-15p125p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL MOLIBDENO
El molibdeno tiene 6 electrones y 12 huecos de segunda valencia [Kr]4d1-51-15s1-15p1-32 distribuidos en los orbitales de la siguiente manera:
[Kr]4d11-14d21-14d31-14d41-14d51-1
5s1-15p125p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL TECNECIO
El tecnecio tiene 7 electrones y 11 huecos de segunda valencia [Kr]4d1-51-15s25p1-32 distribuidos en los orbitales de la siguiente manera:
[Kr]4d11-14d21-14d31-14d41-14d51-1
5s25p125p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL RUTENIO
El rutenio tiene 8 electrones y 10 huecos de segunda valencia [Kr]4d1-224d3-51-15s1-15p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Kr]4d124d224d31-14d41-14d51-1
5s1-15p125p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL RODIO
El rodio tiene 9 electrones y 9 huecos de segunda valencia [Kr]4d1-324d4-51-15s1-15p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Kr]4d124d224d324d41-14d51-1
5s1-15p125p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL PALADIO
El paladio tiene 10 electrones y 8 huecos de segunda valencia [Kr]4d1-525s25p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Kr]4d124d224d324d424d52
5s25p125p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN LA PLATA
La plata tiene a 11 electrones y 7 huecos de segunda valencia [Kr]4d1-525s1-15p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Kr]4d124d224d324d424d52
5s1-15p125p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL CADMIO
El cadmio tiene 12 electrones y 6 huecos de segunda valencia [Kr]4d1-525s25p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Kr]4d124d224d324d424d52
5s25p125p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL INDIO
El indio tiene 13 electrones y 5 huecos de segunda valencia [Kr]4d1-525s25p11-15p2-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Kr]4d124d224d324d424d52
5s25p11-15p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ESTAÑO
El estaño tiene 14 electrones y 4 huecos de segunda valencia [Kr]4d1-525s25p1-21-15p32 distribuidos en los orbitales atómicos de la siguiente manera:
[Kr]4d124d224d324d424d52
5s25p11-15p21-15p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ANTIMONIO
El antimonio tiene 15 electrones y 3 huecos de segunda valencia [Kr]4d1-525s25p1-31-1 distribuidos de la siguiente manera en los orbitales atómicos:
[Kr]4d124d224d324d424d52
5s25p11-15p21-15p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL TELURIO
El telurio tiene 16 electrones y 2 huecos de segunda valencia [Kr]4d1-525s25p125p2-31-1 distribuidos de la siguiente manera en los orbitales atómicos:
[Kr]4d124d224d324d424d52
5s25p125p21-15p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL YODO
El yodo tiene 17 electrones y un solo hueco de segunda valencia [Kr]4d1-525s25p1-225p31-1 distribuidos en los orbitales atómicos de la siguiente manera:
[Kr]4d124d224d324d424d52
5s25p125p225p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL XENÓN
El xenón tiene 18 electrones y sin huecos de segunda valencia [Kr]4d1-525s25p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Kr]4d124d224d324d424d52
5s25p125p225p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL CESIO
El cesio tiene a 1 electrón y 31 huecos de primera valencia [Xe]4f1-725d1-526s1-16p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s1-16p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL BARIO
El bario tiene a 2 electrones y 30 huecos de primera valencia [Xe]4f1-725d1-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL LANTANO
El lantano tiene 3 electrones y 29 huecos de primera valencia [Xe]4f1-725d11-15d2-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d11-15d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL CERIO
El cerio tiene 4 electrones y 28 huecos de primera valencia [Xe]4f11-14f2-725d11-15d2-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f11-14f224f324f424f524f624f72
[Xe]5d11-15d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL PRASEODIMIO
El praseodimio fundamental tiene 5 electrones y 27 huecos de primera valencia [Xe]4f1-31-14f4-725d2-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f11-14f21-14f31-14f424f524f624f72
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL NEODIMIO
El neodimio tiene 6 electrones y 26 huecos de primera valencia [Xe]4f1-41-14f5-725d1-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f11-14f21-14f31-14f41-14f524f624f72
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL PROMETIO
El prometio tiene 7 electrones y 25 huecos de primera valencia [Xe]4f1-51-14f6-725d1-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f11-14f21-14f31-14f41-14f51-14f624f72
[Xe]5d125d225d325d425d52
6s26p126p22»
» 6p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL SAMARIO
El samario tiene 8 electrones y 24 huecos de primera valencia [Xe]4f1-61-14f725d1-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f11-14f21-14f31-14f41-14f51-14f61-14f72
[Xe]5d125d225d325d425d52
6s26p12»
»6p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL EUROPIO
El europio fundamental tiene 9 electrones y 23 huecos de primera valencia [Xe]4f1-71-15d1-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f11-14f21-14f31-14f41-14f51-14f61-14f71-1
[Xe]5d125d225d325d425d52
6s26p12»
»6p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL GADOLINIO
El gadolinio tiene 10 electrones y 22 huecos de primera valencia [Xe]4f1-71-15d11-15d2-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f11-14f21-14f31-14f41-14f51-14f61-14f71-1
[Xe]5d11-15d225d325d425d52
6s26p12»
»6p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL TERBIO
El terbio tiene 11 electrones y 21 huecos de primera valencia [Xe]4f1-224f3-71-15d1-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f31-14f41-14f51-14f61-14f71-1
[Xe]5d125d225d325d425d52
6s26p12»
»6p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL DISPROSIO
El disprosio tiene 12 electrones y 20 huecos de primera valencia [Xe]4f1-324f4-71-15d1-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f41-14f51-14f61-14f71-1
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL HOLMIO
El holmio tiene 13 electrones y 19 huecos de primera valencia [Xe]4f1-424f5-71-15d1-526s26p1-32 distribuidos así en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f51-14f61-14f71-1
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ERBIO
El erbio tiene 14 electrones y 18 huecos de primera valencia [Xe]4f1-524f6-71-15d1-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f61-14f71-1
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL TULIO
El tulio tiene 15 electrones y 17 huecos de primera valencia [Xe]4f1-624f71-15d1-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f71-1
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ITERBIO
El iterbio tiene 16 electrones y 16 huecos de primera valencia [Xe]4f1-725d1-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL LUTECIO
El lutecio tiene 17 electrones y 15 huecos de primera valencia [Xe]4f1-725d11-15d2-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d11-15d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL HAFNIO
El hafnio tiene 18 electrones y 14 huecos de primera valencia [Xe]4f1-725d125d2-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL TANTALIO
El tantalio tiene 19 electrones y 13 huecos de primera valencia [Xe]4f1-725d125d21-15d3-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d21-15d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL WOLFRAMIO
El wolframio tiene 20 electrones y 12 huecos de primera valencia [Xe]4f1-725d1-225d3-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL RENIO
El renio tiene 21 electrones y 11 huecos de primera valencia [Xe]4f1-725d1-225d31-1d4-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d31-15d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL OSMIO
El osmio tiene 22 electrones y 10 huecos de primera valencia [Xe]4f1-725d1-325d4-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL IRIDIO
El iridio tiene 23 electrones y 9 huecos de primera valencia [Xe]4f1-725d1-325d41-15d526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d41-15d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL PLATINO
El platino tiene 24 electrones y 8 huecos de primera valencia [Xe]4f1-725d1-425d51-16s1-16p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d51-1
6s1-16p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ORO
El oro tiene 25 electrones y 7 huecos de primera valencia [Xe]4f1-725d1-526s1-16p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s1-16p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL MERCURIO
El mercurio tiene 26 electrones y 6 huecos de primera valencia [Xe]4f1-725d1-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL TALIO
El talio tiene 27 electrones y 5 huecos de primera valencia [Xe]4f1-725d1-526s26p11-16p2-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s26p11-16p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL PLOMO
El plomo tiene 28 electrones y 4 huecos de primera valencia [Xe]4f1-725d1-526s26p126p2-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL BISMUTO
El bismuto tiene a 29 electrones y 3 huecos de primera valencia [Xe]4f1-725d1-526s26p126p21-16p32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s26p126p21-16p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL POLONIO
El polonio tiene a 30 electrones y 2 huecos de primera valencia [Xe]4f1-725d1-526s26p1-226p32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ASTATO
El astato tiene a 31 electrones y 1 solo hueco de primera valencia [Xe]4f1-725d1-526s26p1-226p31-1 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s26p126p226p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL RADÓN
El radón tiene a 32 electrones y además sin huecos la primera valencia [Xe]4f1-725d1-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d52
6s26p126p226p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL FRANCIO
El francio tiene a 1 solo electrón y 31 huecos de segunda valencia [Rn]5f1-726d1-527s1-17p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s1-17p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL RADIO
El radio tiene a 2 electrones y 30 huecos de segunda valencia [Rn]5f1-726d1-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ACTINIO
El actinio tiene 3 electrones y 29 huecos de segunda valencia [Rn]5f1-726d11-1d2-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d11-16d226d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL TORIO
El torio tiene a 4 electrones y 28 huecos de segunda valencia [Rn]5f1-726d126d2-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL PROTACTINIO
El protactinio tiene 5 electrones y 27 huecos de segunda valencia [Rn]5f1-21-15f3-726d11-16d2-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f11-15f21-15f325f425f525f625f72
Rn]6d11-16d226d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL URANIO
El uranio tiene 6 electrones y 26 huecos de segunda valencia [Rn]5f1-31-15f4-726d11-16d2-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f11-15f21-15f31-15f425f525f625f72
[Rn]6d11-16d226d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL NEPTUNIO
El neptunio tiene a 7 electrones y 25 huecos de segunda valencia [Rn]5f1-41-15f5-726d11-16d2-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f11-15f21-15f31-15f41-15f525f625f72
[Rn]6d11-16d226d326d426d52
7s27p12»
»7p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL PLUTONIO
El plutonio tiene a 8 electrones y 24 huecos de segunda valencia [Rn]5f1-61-15f726d1-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f11-15f21-15f31-15f41-15f51-15f61-15f72
[Rn]6d126d226d326d426d52
7s27p12»
»7p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL AMERICIO
El americio tiene a 9 electrones y 23 huecos de segunda valencia [Rn]5f1-71-16d1-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f11-15f21-15f31-15f41-15f51-15f61-15f71-1
[Rn]6d126d226d326d426d52
7s27p12»
»7p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL CURIO
El curio tiene a 10 electrones y 22 huecos de segunda valencia [Rn]5f1-71-16d11-16d2-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f11-15f21-15f31-15f41-15f51-15f61-15f71-1
[Rn]6d11-16d226d326d426d52
7s27p12»
»7p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL BERKELIO
El berkelio tiene 11 electrones y 21 huecos de segunda valencia [Rn]5f1-225f3-71-16d1-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f31-15f41-15f51-15f61-15f71-1
[Rn]6d126d226d326d426d52
7s27p12»
»7p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL CALIFORNIO
El californio tiene 12 electrones y 20 huecos de segunda valencia [Rn]5f1-325f4-71-16d1-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f41-15f51-15f61-15f71-1
[Rn]6d126d226d326d426d52
7s27p12»
»7p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL EINSTENIO
El einstenio tiene 13 electrones y 19 huecos de segunda valencia [Rn]5f1-425f5-71-16d1-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f51-15f61-15f71-1
[Rn]6d126d226d326d426d52
7s27p12»
»7p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL FERMIO
El fermio tiene 14 electrones y 18 huecos de segunda valencia [Rn]5f1-525f6-71-16d1-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f61-15f71-1
[Rn]6d126d226d326d426d52
7s27p127p227p32»
CONFIGURACION DE ELECTRONES Y HUECOS EN EL MENDELEVIO
El mendelevio tiene 15 electrones y 17 huecos de segunda valencia [Rn]5f1-625f71-16d1-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f71-1
[Rn]6d126d226d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL NOBELIO
El nobelio tiene 16 electrones y 16 huecos de segunda valencia [Rn]5f1-726d1-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL LAWRENCIO
El lawrencio tiene 17 electrones y 15 huecos de segunda valencia [Rn]5f1-726d11-16d2-527s27p1-32 distribuidos en los orbitales atómicos de las siguientes maneras:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d11-16d226d326d426d52
7s27p127p227p32
ó
[Rn]5f1-726d1-527s27p11-17p2-32
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p11-17p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL RUTHERFORDIO
El rutherfordio tiene 18 electrones y 14 huecos de segunda valencia [Rn]5f1-726d126d2-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL DUBNIO
El dubnio tiene 19 electrones y 13 huecos de segunda valencia [Rn]5f1-726d126d21-16d3-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d21-16d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL SEABORGIO
El seaborgio tiene 20 electrones y 12 huecos de segunda valencia [Rn]5f1-726d1-226d3-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL BOHRIO
El bohrio tiene 21 electrones y 11 huecos de segunda valencia [Rn]5f1-726d1-226d31-16d4-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d31-16d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL HASSIO
El hassio tiene 22 electrones y 10 huecos de segunda valencia [Rn]5f1-726d1-326d4-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL MEITNERIO
El meitnerio con 23 electrones y 9 huecos de segunda valencia [Rn]5f1-726d1-326d41-16d527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d41-16d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL DARMSTADIO
El darmastadio tiene 24 electrones y 8 huecos de segunda valencia [Rn]5f1-726d1-426d51-17s1-17p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d51-1
7s1-17p127p227p32»
CONFIGURACION DE ELECTRONES Y HUECOS EN EL ROENTGENIO
El roentgenio tiene 25 electrones y 7 huecos de segunda valencia [Rn]5f1-726d1-527s1-17p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s1-17p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL COPERNICIO
El copernicio tiene 26 electrones y 6 huecos de segunda valencia [Rn]5f1-726d1-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL UNUNTRIO
El ununtrio tiene 27 electrones y 5 huecos de segunda valencia [Rn]5f1-726d1-527s27p11-17p2-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p11-17p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL FLEROVIO
El flerovio tiene 28 electrones y 4 huecos de segunda valencia [Rn]5f1-726d1-527s27p127p2-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL UNUNPENTIO
El ununpentio tiene 29 electrones y 3 huecos de segunda valencia [Rn]5f1-726d1-527s27p127p21-17p32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p127p21-17p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL LIVERMORIO
El livermorio tiene 30 electrones y 2 huecos de segunda valencia [Rn]5f1-726d1-527s27p1-227p32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p127p227p32
CONFIGURACION DE ELECTRONES Y HUECOS EN EL UNUNSEPTIO
El ununseptio tiene 31 electrones y 1 hueco de segunda valencia [Rn]5f1-726d1-527s27p1-227p31-1 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p127p227p31-1
CONFIGURACION DE ELECTRONES Y HUECOS EN EL UNUNOCTIO
El ununoctio tiene 32 electrones y sin huecos de segunda valencia [Rn]5f1-726d1-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p127p227p32
3- Conclusiones:
a)-LA PRIMERA GRAN CONCLUSIÓN es la explicación del porqué el oxígeno si en realidad tiene a 6 electrones genéricos de valencia, solo trabaja con dos estados de oxidación.
El oxígeno tiene a 6 electrones genéricos de valencia y 2 huecos también genéricos de valencia pero es la primera valencia de dos posibles [He]2s22p122p2-31-1, eso lo diferencia del azufre quien ostenta la segunda valencia, el oxígeno tiene tiene siguiente distribuiión electrónica:
[He]
2s22p122p21-12p31-1
El selenio a pesar de que tiene la misma cantidad de huecos que el oxígeno, es la primera valencia con 16 electrones.
b)-LA SEGUNDA GRAN CONCLUSIÓN es que el cromo permite la libertad que le da el principio de Madelung en el espín del electrón s subsiguiente solo hasta llegar a la cercanía del tercer orbital, que ocurre normalmente en el vanadio por lo tanto, no permite que estén apareados los dos electrones s en el subnivel s, Hundreglamentario hasta en el 4d4.
Vanadio con 5 electrones genéricos de valencia, 13 huecos también genéricos de valencia [Ar]3d1-31-13d4-524s24p1-32 distribuidos de la siguiente manera:
[Ar]3d11-13d21-13d31-13d423d52
4s24p124p224p32
El cromo al igual que el oxígeno tiene 6 electrones genéricos de valencia pero con 12 huecos también genéricos de valencia [Ar]3d1-51-14s1-14p1-32 que están distribuidos de una manera distinta como es la siguiente:
[Ar]3d11-13d21-13d31-13d41-13d51-1
4s1-14p124p224p32
c)-LA TERCERA GRAN CONCLUSIÓN es que el cobre guarda la misma distancia del cromo para permitir la libertad del espín s subsiguiente.
El níquel tiene 10 electrones genéricos de valencia y 8 huecos también genéricos de valencia [Ar]3d1-323d4-51-14s24p1-32 distribuidos de la siguiente manera:
[Ar]3d123d223d323d41-13d51-1
4s24p124p224p32
El cobre tiene a 11 electrones de valencia y 7 huecos también de valencia [Ar]3d1-524s1-14p1-32 distribuidos de la siguiente manera:
[Ar]3d123d223d323d423d52
4s1-14p124p224p32
d)-LA CUARTA GRAN CONCLUSIÓN es que el molibdeno a pesar de que cumple la regla de Hund y mantiene la misma cantidad genérica de electrones y huecos de valencia del cromo, ssubsiguiente desde el niobio.
El niobio con 5 electrones genéricos de valencia y 13 huecos también genéricos de valencia [Kr]4d1-41-14d525s1-15p1-32 distribuidos en los orbitales de la siguiente manera:
[Kr]4d11-14d21-14d31-14d41-14d52
5s1-15p125p225p32
El molibdeno tiene 6 electrones y 12 huecos de valencia también genéricos de valencia [Kr]4d1-51-15s1-15p1-32 distribuidos en los orbitales de la siguiente manera:
[Kr]4d11-14d21-14d31-14d41-14d51-1
5s1-15p125p225p32
e)-LA QUINTA GRAN CONCLUSIÓN es que en muchas ocasiones para hallar la estabilidad, los elementos deben recurrir a la regla de Hund modificada para estabilizar al átomo como le sucede al rutenio, al rodio e incluso quitar al electrón s si estorba y reemplazarlo por un hueco como lo hace el paladio con el electrón s y algunos elementos del grupo f con un electrón del d.
A diferencia del vanadio el rutenio no permite la misma cercanía del electrón s de espin opuesto.
El rutenio tiene 8 electrones de valencia y 10 huecos también genéricos de valencia [Kr]4d1-224d3-51-15s1-15p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Kr]4d124d224d31-14d41-14d51-1
5s1-15p125p225p32
El rodio tiene a 9 electrones de valencia y 9 huecos también de valencia [Kr]4d1-324d4-51-15s1-15p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Kr]4d124d224d324d41-14d51-1
5s1-15p125p225p32
El paladio tiene 10 electrones de valencia y 8 huecos también de valencia [Kr]4d1-525s25p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Kr]4d124d224d324d424d52
5s25p125p225p32
La plata tiene a 11 electrones y 7 huecos de segunda valencia [Kr]4d1-525s1-15p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Kr]4d124d224d324d424d52
5s1-15p125p225p32
f)-LA SEXTA GRAN CONCLUSIÓN es que los lantánidos cumplen la regla de Hund modificada es con el subsiguiente subnivel d del siguiente nivel de energía. Por frecurre al 5d y el 5f recurre al 6d.
En el lantano y el actinio sucede con el f lo mismo que ocurre con el d en el potasio, el rubidio y el escandio. El d en el lantano y el actinio es el mismo s del potasio y el rubidio.
El potasio tiene 1 solo electrón y 17 huecos en la primera valencia [Ar]3d1-524s1-14p1-32 distribuidos de la siguiente manera:
[Ar]3d123d223d323d423d52
4s1-14p124p224p32
El lantano tiene 3 electrones y 29 huecos de primera valencia [Xe]4f1-725d11-15d2-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d11-15d225d325d425d52
6s26p126p226p32
El rubidio tiene un solo electrón y 17 huecos de segunda valencia [Kr]4d1-525s1-15p1-32 distribuidos de la siguiente manera:
[Kr]4d124d224d324d424d52
5s1-15p125p225p32
El actinio tiene 3 electrones y 29 huecos de segunda valencia [Rn]5f1-726d11-1d2-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d11-16d226d326d426d52
7s27p127p227p32
El electron de 4f11-1 del cerio está demasiado lejos del electron 5d11-1.
El cerio tiene 4 electrones y 28 huecos de primera valencia [Xe]4f11-14f2-725d11-15d2-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f11-14f224f324f424f524f624f72
[Xe]5d11-15d225d325d425d52
6s26p126p226p32
Al torio le ocurre con el f, lo mismo que le ocurre con el d al calcio y el estroncio.
El calcio tiene 2 electrones y 16 huecos de primera valencia [Ar]3d1-524s24p1-32distribuidos de la siguiente manera:
[Ar]3d123d223d323d423d52
4s24p124p224p32
El estroncio tiene 2 electrones y 16 huecos de segunda valencia [Kr]4d1-525s25p1-32 distribuidos de la siguiente manera:
[Kr]4d124d224d324d424d52
5s25p125p225p32
El torio tiene a 4 electrones y 28 huecos de segunda valencia [Rn]5f1-726d126d2-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f125f225f325f425f525f625f72
[Rn]6d126d226d326d426d52
7s27p127p227p32
El gadolinio tiene 10 electrones de valencia y 22 huecos también de valencia [Xe]4f1-71-15d11-15d2-526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f11-14f21-14f31-14f41-14f51-14f61-14f71-1
[Xe]5d11-15d225d325d425d52
6s26p12»
»6p226p32
El curio tiene a 10 electrones de valencia y 22 huecos también de valencia [Rn]5f1-71-16d11-16d2-527s27p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Rn]5f11-15f21-15f31-15f41-15f51-15f61-15f71-1
[Rn]6d11-16d226d326d426d52
7s27p12»
»7p227p32
g)-LA SEPTIMA GRAN CONCLUSIÓN es las anomalías de los grupos d con lantánidosy actínidos como le sucede al platino.
Curiosamente los elementos ubicados desde el lutecio hasta el iridio, no violan la regla de Madelung. Sin embargo el llenado del subnivel 5d o 6d de estos elementos inicialmente es apareado, es decir, de forma especial en ellos se desarrolla el llenado de una manera inversa de regla de Hund, pero cuando ese llenado apareado llega tan cerca del s ubicdo en el subsiguiente nivel como ocurre en el iridio, Hund por ejemplo en el platino.
Parece que esta forma de relleno en los post-lantánidos y post-actínido continúa igual en el subnivel p y parecen ser la razón que ocasiona los efectos del par inerte en estos elementos.
El iridio tiene 23 electrones y 9 huecos también genéricos de valencia [Xe]4f1-725d1-325d41-15d526s26p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d41-15d52
6s26p126p226p32
El platino tiene 24 electrones y 8 huecos genéricos también de valencia [Xe]4f1-725d1-425d51-16s1-16p1-32 distribuidos en los orbitales atómicos de la siguiente manera:
[Xe]4f124f224f324f424f524f624f72
[Xe]5d125d225d325d425d51-1
6s1-16p126p226p32
h)-LA ULTIMA GRAN CONCLUSIÓN ES LA NUEVA TABLA PPERIODICA
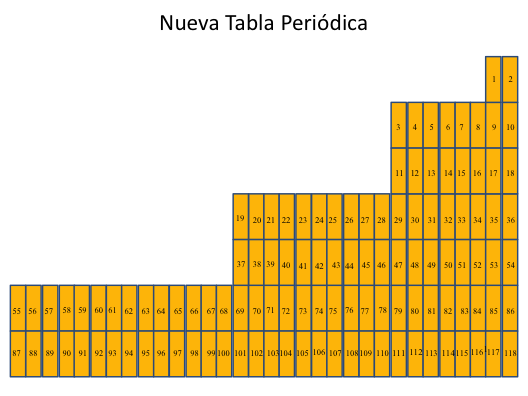
Nueva Tabla periódica en que los elementos están ordenados por su número atómico y el número de huecos. Hay un total de 32 grupos que numerados aumentan el número atómico de izquierda a derecha y de arriba hacia abajo a medida que disminuye el número de huecos solo de izquierda a derecha en los grupos, hasta llegar a los halógenos que tienen un solo hueco y en el extremo derecho se sitúan los gases nobles que carecen de huecos. Los elemento situados en el extremo izquierdo el mayor número de huecos que son 31 huecos. Los elementos que integran el mismo grupo, tiene el mismo número de huecos.
4- Referencias
REFERENCIAS DEL ARTÍCULO.
[1] Nueva tabla periódica.
[2] Nueva tabla periódica.
[3] Ciclo del Ozono
[4] Ciclo del Ozono
[5] Barrera Interna de Potencial
[6] Barrera Interna de Potencial
[7] Ácido Fluoroantimónico.
[8] Ácido Fluoroantimónico.
[9] Dióxido de cloro
[10]Dióxido de cloro
[11]Pentafluoruro de Antimonio
[12]Pentafluoruro de Antimonio
[13]Tetróxido de Osmio
[14]Enlaces Hipervalentes
[15]Enlaces en moléculas Hipervalentes
[16]Nueva regla del octeto
[17]Estado fundamental del átomo
[18]Estado fundamental del átomo
[19]Barrera rotacional del etano.
[20]Enlaces de uno y tres electrones.
[21]Enlaces de uno y tres electrones.
[22]Origen de la barrera rotacional del etano
[23]Monóxido de Carbono
[24]Nueva regla fisicoquímica del octeto
[25]Células fotoeléctricas Monografías.
[26]Células Fotoeléctricas textoscientificos.
[27]Semiconductores Monografías.
[28]Semiconductores textoscientificos.
[29]Superconductividad.
[30]Superconductividad.
[31]Alotropía.
[32]Alotropía del Carbono.
[33]Alotropía del Oxigeno.
[34]Ozono.
[35]Diborano
[36]Semiconductores y temperatura.
REFERENCIAS DE LA TEORÍA
[1] Número cuántico magnético.
[2] Ángulo cuántico
[3] Paul Dirac y Nosotros
[4] Numero cuántico Azimutal monografias
[5] Numero cuántico Azimutal textoscientificos
[6] Inflación Cuántica textos científicos.
[7] Números cuánticos textoscientíficos.com.
[8] Inflación Cuántica Monografías
[9] Orbital Atómico
[10] Números Cuánticos.
[11] Átomo de Bohr.
[12] Líneas de Balmer.
[13] Constante Rydberg.
[14] Dilatación gravitacional del tiempo.
[15] Número Cuántico magnético.
[16] Numero Cuántico Azimutal.
Copyright © Derechos Reservados.
Heber Gabriel Pico Jiménez MD. Médico Cirujano 1985 de la Universidad de Cartagena Colombia. Investigador independiente de problemas biofísicos médicos propios de la memoria, el aprendizaje y otros entre ellos la enfermedad de Alzheimer.
Estos trabajos, que lo más probable es que estén desfasados por la poderosa magia secreta que tiene la ignorancia y la ingenuidad, sin embargo, como cualquier representante de la comunidad académica que soy, también han sido debidamente presentados sobretodo este se presentó el 26 de Enero del 2014 en la “Academia Colombiana de Ciencias Exactas, Físicas y Naturales” ACCEFYN.