El etilenglicol, 1,2-etanodiol, HOCH2CH2OH, generalmente se lo llama glicol, y es el diol más simple. Fue preparado por primera vez por Wurtz en 1859; mediante el tratamiento de 1,2-dibromoetano con acetato de plata dando diacetato de etilenglicol, que a continuación se hidroliza al etilenglicol.
El etilenglicol se utilizó por primera industrialmente en lugar de glicerol durante la Primera Guerra Mundial como un intermedio para explosivos (dinitrato de etilenglicol), pero desde entonces se ha convertido en un importante producto industrial.
La capacidad mundial para la producción de etilenglicol a través de la hidrólisis de óxido de etileno se estima en alrededor de 7x106 toneladas al año.
El etilenglicol se utiliza principalmente como un anticongelante en radiadores de automóviles y como materia prima para la fabricación de fibras de poliéster.
Propiedades Físicas del etilenglicol
El etilenglicol es un líquido transparente, incoloro, inodoro, de sabor dulce. Es higroscópico y completamente miscible con muchos disolventes polares, tales como el agua, alcoholes, éteres de glicol, y acetona. Sin embargo, su solubilidad es baja en solventes no polares, tales como el benceno, tolueno, dicloroetano, y cloroformo.
Las siguientes son algunas de las propiedades físicas de etilenglicol:
| Punto de ebullición a 101,3 kPa | 197,60 ºC |
| Punto de fusión | -13,00 ºC |
| Densidad a 20 ºC | 1,1135 g / cm3 |
| Índice de refracción, nD20 | 1,4318 |
| Calor de vaporización a 101,3 kPa | 52,24 kJ / mol |
| Calor de combustión | 19,07 MJ / kg |
| Temperatura crítica | 372ºC |
| Volumen crítico | 6515,73 kPa |
| Presión crítica | 0.186L / mol |
| Punto de inflamabilidad | 111ºC |
| Temperatura de ignición | 410ºC |
| Límite explosivo inferior | 3,20 vol% |
| Límite explosivo superior | 53vol% |
| Viscosidad a 20 ºC | 19.83 mPa · s |
| Coeficiente de dilatación cúbica a 20ºC | 0,62 × 10-3 K-1 |
El etilenglicol es difícil de cristalizar; cuando se enfría, se forma una masa altamente viscosa subenfriada, que finalmente solidifica para producir una sustancia semejante al vidrio.
Mezclas Etilenglicol Agua
El uso generalizado de etilenglicol como anticongelante se basa en su capacidad para reducir el punto de congelación cuando se mezcla con agua. Las propiedades físicas de mezclas de agua-etilenglicol son, por lo tanto, extremadamente importantes. Los puntos de congelación de las mezclas de agua con monoetilenglicol y dietilenglicol se muestran en la Figura 1.
Las dependencias de la temperatura de la conductividad térmica, densidad y viscosidad de etilenglicol y mezclas de etilenglicol - agua se muestran en las Figuras 2, 3, y 4, respectivamente. Los números de Prandtl (la relación de la viscosidad a la conductividad térmica) derivados de estos valores se dan en la Figura 5. Las presiones de vapor de mezclas de etilenglicol - agua han sido obtenidas a partir de interpolación y se enumeran en la Tabla 1
Tabla 1. presión de vapor de mezclas etilenglicol - agua
Contenido de agua, % en peso |
Presión de vapor, en kPa |
||
|---|---|---|---|
a 65,1 ◦C |
a 77.7 ◦C |
a 90.3 ◦C |
|
0 |
0.30 |
0.52 |
1.20 |
10 |
6.61 |
11.65 |
19.73 |
20 |
11.30 |
19.68 |
33.01 |
30 |
14.70 |
25.45 |
42.49 |
40 |
17.10 |
29.68 |
49.37 |
50 |
18.81 |
32.92 |
54.60 |
60 |
20.16 |
35.58 |
58.87 |
70 |
21.45 |
37.92 |
62.60 |
80 |
22.98 |
40.05 |
65.98 |
90 |
25.08 |
41.91 |
68.93 |
100 |
28.04 |
43.34 |
71.10 |
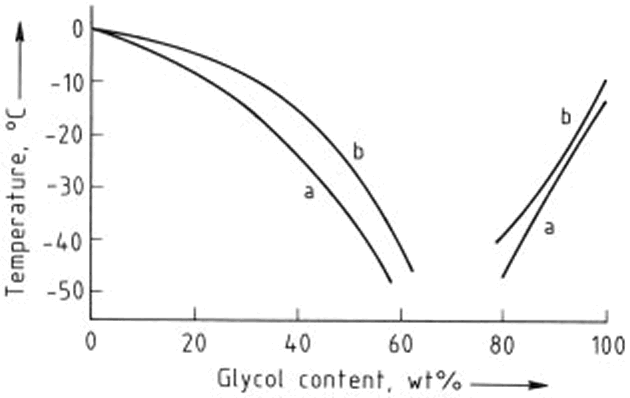
Figura 1. Los puntos de congelación de mezclas de mono etilenglicol y dietilenglicol con agua
a) monoetilenglicol; b) El dietilenglicol
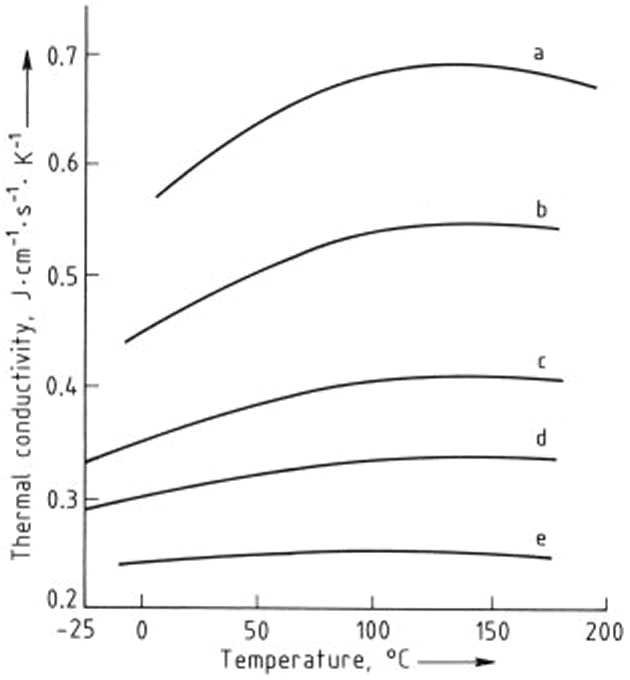
Figura 2. Dependencia de la temperatura de la conductividad térmica de mezclas de etilenglicol - agua
Contenido de etilenglicol ,% en moles: a) 0; b) 25; c) 55; d) 75; e) 100
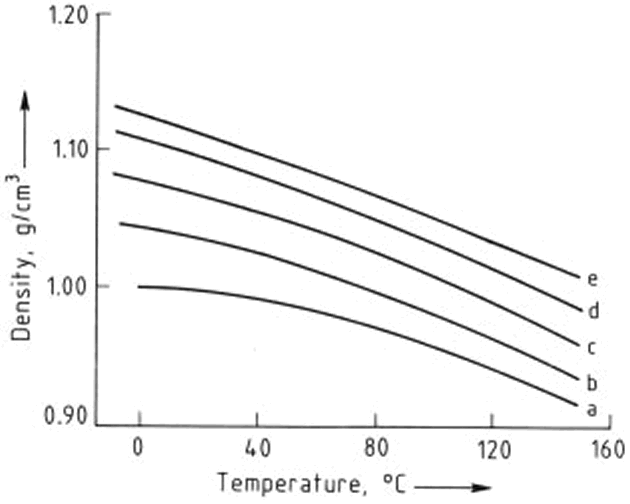
Figura 3. Dependencia de la temperatura de la densidad de mezclas etilenglicol - agua
Contenido de etilenglicol,% en moles: a) 0; b) 26,1; c) 50,95; d) 76,9; e) 100
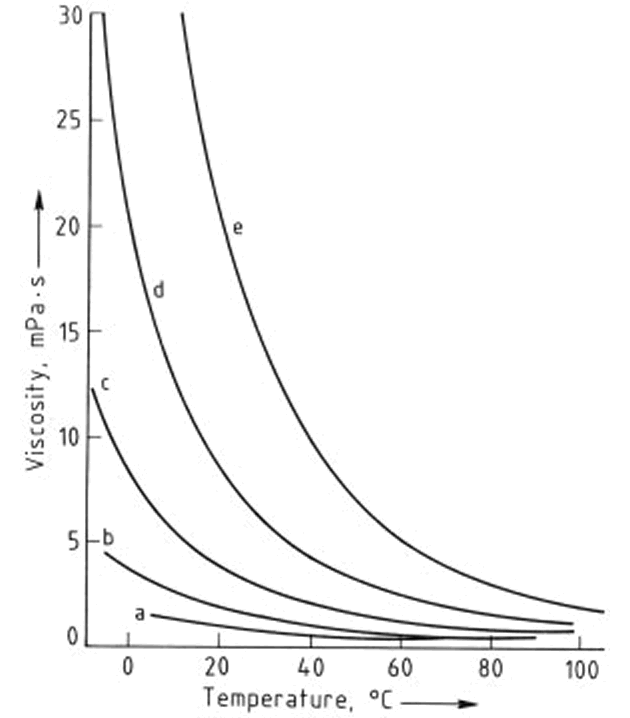
Figura 4. Dependencia de la temperatura de la viscosidad de mezclas etilenglicol - agua
Contenido de etilenglicol,% en moles: a) 0; b) 25; c) 49,90; d) 74,36; e) 100
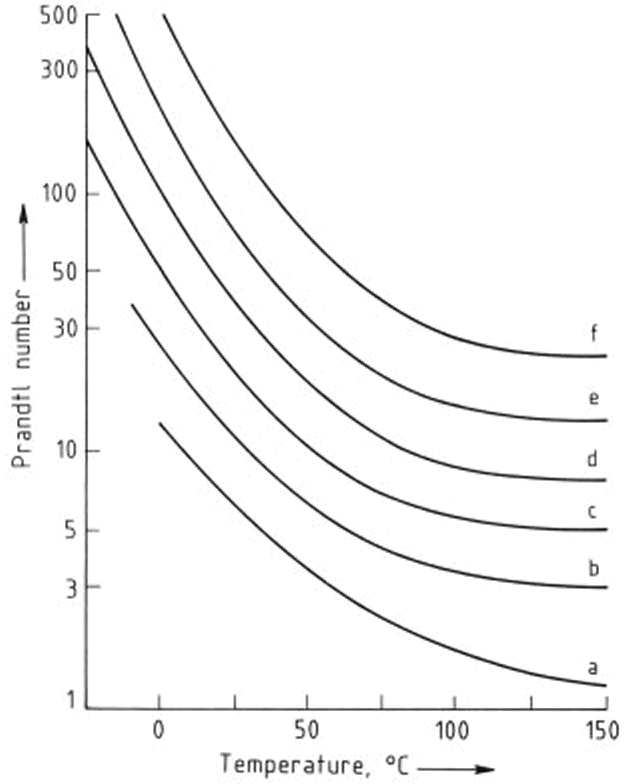
Figura 5. Dependencia de la temperatura de los números de Prandtl de mezclas etilenglicol - agua
Contenido de etilenglicol,% en moles: a) 0; b) 20; c) 40; d) 60; e) 80; f) 100
Propiedades químicas del etilenglicol
Al igual que otros alcoholes el etilenglicol se somete a las reacciones típicas de sus grupos hidroxilo. Aquí sólo consideraremos las características químicas especiales y reacciones industrialmente importantes del etilenglicol. Los dos grupos hidroxilo adyacentes permiten la ciclación, y la policondensación; uno o ambos de estos grupos funcionales pueden, por supuesto, también reaccionan para dar otros derivados.
Oxidación.
El etilenglicol se oxida fácilmente por el oxígeno, ácido nítrico, y otros agentes oxidantes para formar un número de aldehídos y ácidos carboxílicos. Los productos típicos derivados de las funciones alcohólicas son glicolaldehıdo (HOCH2 CHO), ácido glioxílico (HOCH2COOH), glioxal (CHOCHO), ácido glioxílico (HCO- COOH), ácido oxálico (HOOCCOOH), formaldehído (HCHO) y ácido fórmico (HCOOH). La variación de las condiciones de reacción puede conducir a la formación selectiva de un producto de oxidación deseado. La oxidación en fase gaseosa con aire en presencia de catalizadores de cobre es de importancia industrial para la producción de glioxal. Escisión glicol se produce en solución ácida con agentes oxidantes cier- tos tales como el permanganato, peryodato, o tetraacetato de plomo. La ruptura del enlace C-C produce principalmente formaldehído, parte del cuale se oxida adicionalmente a ácido fórmico.
Formación de 1,3-dioxolano.
Los 1,3-dioxolanos se forman por reacción de glicol de etileno con compuestos de carbonilo:
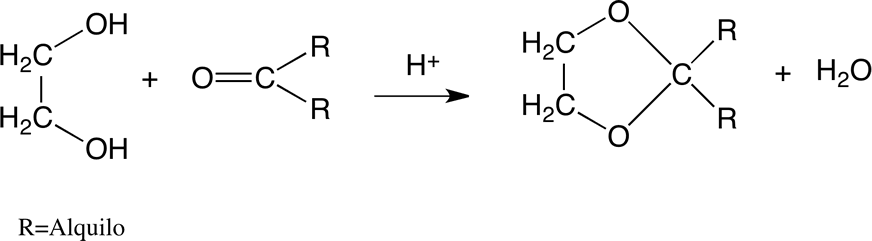
La acetalización de los cíclicos de 1,3-dioxolano se produce más fácilmente que la formación de acetal a partir de alcoholes de cadena lineal. Si se elimina el agua de la mezcla de reacción se puede obtener un excelente rendimiento. Esta reacción se utiliza para proteger a los grupos carbonilo en síntesis orgánicas.
También se pueden formar 1,3-dioxolanos a partir de etilenglicol por transacetalización. Ejemplos de esto son las reacciones de etilenglicol con ortoformiatos:
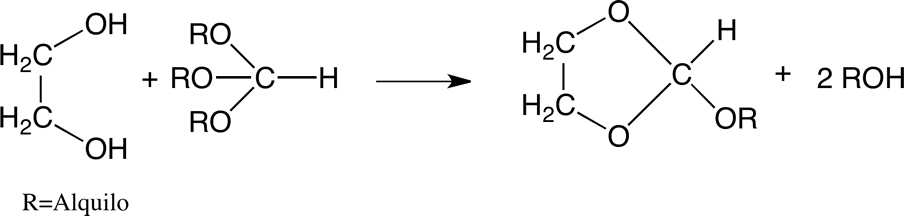
o con carbonatos de dialquilo:
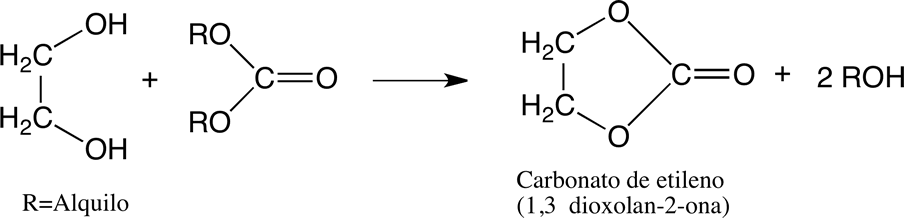
Formación de 1,4-dioxano.
El etilenglicol se puede convertir en dioxano por deshidratación en presencia de catalizadores ácidos:
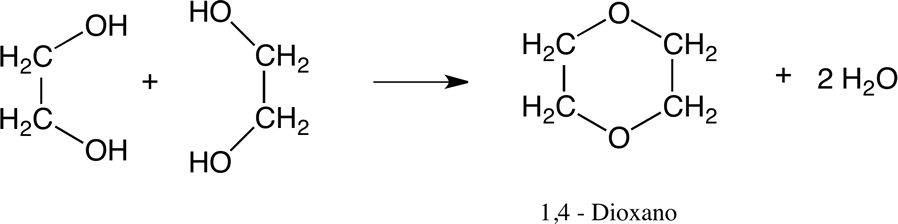
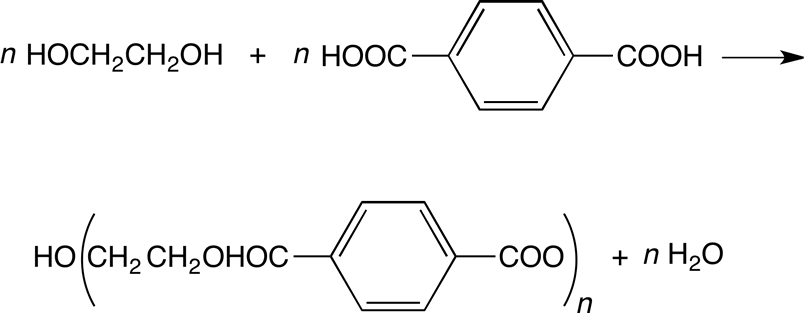
Formación de éter y éster.
El etilenglicol puede ser alquilado o acilado por los métodos habituales para formar éteres o ésteres, respectivamente. Sin embargo, la presencia de dos grupos hidroxilo conduce a la formación de mono y diéteres y mono y diésteres, dependiendo de las concentraciones iniciales de los reactivos individuales. La esterificación de etilenglicol con ácido tereftálico para formar poliésteres es especialmente importante en la industria por su aplicación como fibras sintéticas.
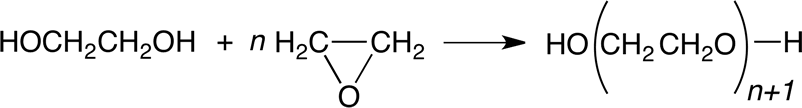
Etoxilación.
El etilenglicol reacciona con óxido de etileno para formar di-, tri-, tetra-, y poly- glicoles de etileno. Las proporciones de estos glicoles que se encuentran en el producto de reacción son determinadas por el sistema de catalizador que se utiliza y el exceso de glicol. Se requiere un exceso considerable de glicol para obtener los homólogos inferiores en un rendimiento satisfactorio. Esta reacción se utiliza raramente industrialmente ya que estos homólogos se forman como subproductos durante la producción de etilenglicol.
Descomposición con hidróxido alcalino.
El glicol es un compuesto relativamente estable, pero se requiere especial cuidado cuando se calienta etilenglicol (o dietilenglicol) a una temperatura más alta en presencia de una base tal como hidróxido de sodio. La fragmentación de la molécula comienza a temperaturas superiores a 250 ºC y es acompañada por la evolución exotérmica de hidrógeno (ΔH = -90 a -160 kJ / kg). Esto conduce a una acumulación de presión en recipientes cerrados.