Hasta los años ochenta solo se conocían dos formas alotrópicas del carbono elemental, que eran el grafito, en el cual los átomos de carbono forman capas de anillos hexagonales y planos de carbono, donde cada átomo de carbono se une a otros tres de una misma capa y no hay enlaces covalentes entre los átomos de carbono de diferentes capas las cuales se mantienen unidas por débiles interacciones de Van der Waals. De esta forma el grafito esta constituido por capas formadas por anillos aromáticos fusionados. La otra forma es el diamante, en el cual los átomos de carbono se encuentran unidos por fuertes enlaces covalentes donde cada átomo de carbono se une tetraédricamente a otros cuatro formando una red tridimensional que es la que le proporciona la rigidez y dureza típica del diamante.
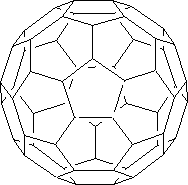
En 1985 los Profesores Kroto y Smalley, cuando estaban realizando experimentos en los que se trataba de convertir carbono gaseoso en partículas (hollín), fenómeno que se produce en las estrellas, encontraron unas nuevas estructuras estables de las cuales la más abundante fue una molécula de fórmula C60, la cual constituye una nueva forma de carbono, junto con ella se obtuvo en menor medida el C70.
En el C60 cada átomo de carbono esta unido a otros tres átomos utilizando para ello orbitales sp2 con un electrón en cada orbital. El cuarto electrón de valencia de cada carbono se encontraría en un orbital p perpendicular a la superficie esférica, de esta manera los orbitales se solapan formando un continuo de orbitales con electrones p por dentro y fuera de la esfera de igual forma a como tiene lugar en el benceno con los seis electrones p que le confieren el carácter aromático. Esto hace que podamos considerar a los fullerenos como una esfera aromática y estable.
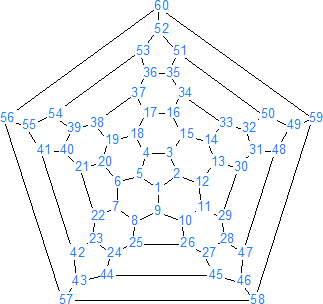
La estructura del C60 es similar a la de una pelota de fútbol (de ahí el nombre de futbolanos o buckybolas como también se les conoce) es decir, tiene forma de un icosaedro truncado con 60 vértices, en cada uno de los cuales se encuentra un carbono. Tiene 32 caras, de las cuales 12 son pentágonos y las 20 restantes son hexágonos, además cada pentágono esta rodeado de cinco hexágonos, de forma que dos pentágonos no pueden ser adyacentes entre sí, pero los seis enlaces de cada hexágono están fusionados alternadamente a tres pentágonos y tres hexágonos.
En general, se conoce con el término de fullerenos (en honor del arquitecto Buckminster Fuller) a todas aquellas estructuras formadas por anillos pentagonales y hexagonales.
En cuanto al comportamiento químico de este tipo de compuestos, aún cuando no son aromáticos en el sentido de cómo lo es el benceno, experimentan reacciones de adición al doble enlace (no pueden experimentar reacciones de sustitución ya que no tienen hidrógenos).
C60 ![]() C60Br2 +
C60 Br4
C60Br2 +
C60 Br4
También es capaz de reaccionar con el cloro a temperaturas mayores (>300ºC).
Hay que tener en cuenta que los 60 carbonos son equivalentes (como sucede en el benceno) pero no así los enlaces. El C60 presenta dos tipos de enlaces, los enlaces 6-6 compartidos por hexágonos adyacentes y los enlaces 5-6 compartidos por un pentágono y un hexágono. Los enlace 6-6 son más cortos (1,39 A) que los enlaces 5-6 (1,43 A) y son más parecidos a los dobles enlaces por lo cual la mayoría de las adiciones se llevan a cabo en un enlace 6-6.
La importancia que tiene el descubrimiento de estos tipos de moléculas es que abre un nuevo campo de posibles aplicaciones en la elaboración de nuevos tipos de polímeros, superconductores, estructuras con metales o con otros átomos atrapados dentro de estos agrupamientos de carbono, así como nuevos catalizadores, productos farmacéuticos y otras posibles aplicaciones industriales.