The carbon monoxide
Por Heber Gabriel Pico Jiménez MD
Resumen
Gracias a la nueva regla del octeto se logra explicar la estructura intima del monóxido de carbono, sobretodo el esclarecimiento de como ocurre el tercer enlace de la molécula que es un enlace coordinado y de qué manera, aun así el átomo de carbono alcanza conservar a un par de electrones libres. Que el átomo de oxigeno permita ser una base Lewis en la molécula de monóxido no es sorprendente, pero que el átomo de carbono se comporte como un ácido de Lewis hasta ahora, había sido inexplicable. Por eso este trabajo además de que lo explica hace la comparación de lo que le sucede al átomo de carbono en el monóxido, con lo que le sucede al átomo de plomo en los iones atípicos divalentes de plomo y estaño. La nueva regla del octeto revoluciona al enlace coordinado ya que así como la base de Lewis tiene disponibles a un par de electrones solitarios como partículas, pues el ácido de Lewis no se queda atrás y ofrece también como partículas a un par de huecos solitarios apareados y en los enlaces coordinados, se hace es un intercambio de partículas para al final configurar a un enlace covalente común y corriente tipo I o enlace covalente tipo mixto-mixto.
Palabras claves: Los gases nobles son los únicos átomos neutros.
Abstract
Thanks to the new rule of byte is achieved to explain structure intima of the carbon monoxide, above all the clarification of as the third link of the molecule which is a coordinated link and how, the carbon atom reaches to keep a couple of free electrons. That the atom of oxygen allows a base Lewis in the monoxide molecule is not surprising, but the carbon atom behaves as a Lewis acid so far, was inexplicable. Why this work that explains what makes the comparison of what happens to the carbon atom in the monoxide, which happens to lead atom in the atypical divalent lead and Tin ions. New rule of byte revolutionizes the coordinated binding since as well as Lewis base presents a couple of lone electrons as particles, because the Lewis acid is not far behind and offers also as particles to a pair of matched solitary holes and on the coordinated link, is made it is an exchange of particles to configure a type I covalent bond or Covalent mixto-mixto type.
Keywords: The noble gases are the only neutral atoms.
1. Introducción
Precisamos que todo el desarrollo de este artículo, estará siempre sostenido en el principio de que químicamente los electrones por lo general, estarán casi siempre apareados. Bajo este principio se desarrollan los anteriores trabajos de energía atómica Número cuántico magnético del electrón, el trabajo de la superconductividad, el artículo del acoplamiento espín-órbita del electrón, además el anterior trabajo de Semiconductores y el de Células fotoeléctricas publicado en textoscientificos y Monografías. También este artículo se basa en la nueva regla del octeto.
2. Desarrollo del Tema.
Sabemos que por la nueva regla del Octeto el átomo de carbono, puede tener las dos siguientes configuraciones estructurales de valencia:
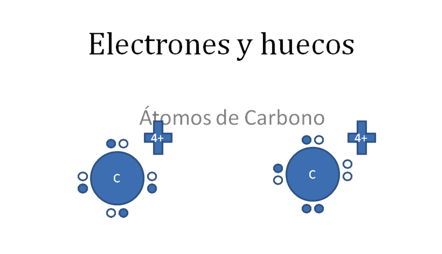
Cada átomo de carbono tiene a 4 electrones de valencia identificados por círculos pequeños rellenos y los 4 huecos representados por círculos pequeños vacíos.
Figura No.1
El átomo de oxígeno según la nueva regla del octeto, tiene la siguiente configuración en su último nivel de valencia:
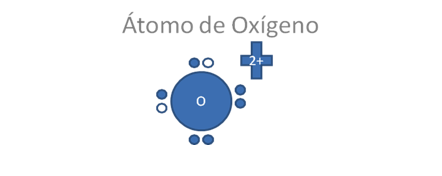
El átomo de oxígeno tiene a 6 electrones de valencia y dos de ellos están apareados con dos huecos, los pequeños círculos rellenos corresponden a los electrones y los pequeños círculos vacíos corresponden a los huecos.
Figura No.2
Incluyendo en una misma figura al átomo de carbono y al átomo de oxígeno. Vemos que el átomo de carbono organiza su octeto con un par exclusivo de electrones libres y un par exclusivo de huecos libres, mientras el átomo de oxigeno solo tiene a dos pares exclusivos de electrones libres:
Los pequeños círculos rellenos son los electrones y los círculos pequeños vacíos son los huecos.
ENLACE SIMPLE CARBONO-OXÍGENO
El enlace C-O está fuertemente polarizado con la negatividad relativa +2 del oxigeno, frente al carbono +4 y por eso muchos alcoholes son solubles en agua por esta polaridad y por la formación de enlaces de hidrógeno.
La longitud de enlace para los enlaces simple C-O, tiene un valor aproximado de 143 picometros, menor que la longitud de enlace C-C o C-N.
Un enlace simple acortado se encuentra en los ácidos carboxilicos (136 pm) debido al carácter de doble enlace parcial.
Un enlace simple C-O alargado se encuentra en los epóxidos (147 pm).
La energía de enlace C-O es también mayor que las de los enlace C-C o C-N por ejemplo, la energía de enlace en el metanol a 298 K es de 91 Kcal/mol, mientras es de 87 Kcal/mol en la metilamina y 88 Kcal/mol en el etano.
Si los átomos de oxigeno y carbono establecen un solo enlace covalente tipo I o enlace covalente tipo mixto-mixto, queda de esta manera en la siguiente figura:
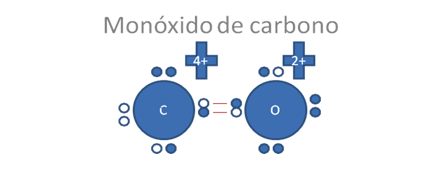
Los círculos rellenos, pequeños y oscuros representan a los electrones y los círculos vacíos y pequeños representan a los huecos, los pares de barras rojas representan a un enlace covalente tipo I o tipo mixto-mixto.
Figura No.3.

Los círculos rellenos, pequeños y oscuros representan a los electrones y los círculos vacíos y pequeños representan a los huecos, los pares de barras rojas representan a un enlace covalente tipo I o tipo mixto-mixto.
Figura No.3.
ENLACE DOBLE CARBONO-OXIGENO
El carbono y el oxígeno forman enlace doble terminal C=O llamado grupo carbonilo en grupos funcionales como la cetona, esteres, ácidos carboxílicos y muchos más. También se encuentran enlaces C=O internos en iones oxonio, cargados positivamente, pero sobretodo aparece en compuestos intermediarios de reacción.
Las longitudes de los enlaces C=O son de aproximadamente 123 pm en los compuestos carbonilos. La longitud de enlace C=O en los haluros de acilo tienen carácter parcial de triple enlace y consecuentemente es de 117 pm, o sea más corto. Los enlaces dobles C=O tienen energías muy altas incluso mayores que las del triple enlace N-N.
Ahora si ese átomo de carbono en la anterior figura establece a dos enlaces covalentes tipo I o enlace covalente tipo mixto-mixto con el átomo de oxígeno:
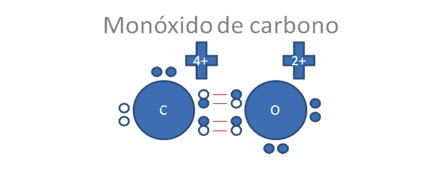
Los círculos pequeños y rellenos son los electrones y los círculos pequeños y vacios corresponden a los huecos, los pares de barras rojas corresponden a un solo enlace covalente tipo mixto-mixto.
Figura No.4
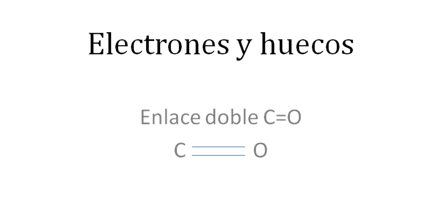
Los círculos pequeños y rellenos son los electrones y los círculos pequeños y vacios corresponden a los huecos, los pares de barras rojas corresponden a un solo enlace covalente tipo mixto-mixto.
Figura No.4
QUIMICA DE LOS ENLACES C-O y C=O
En química orgánica, la reactividad de los enlaces carbono-oxígeno se deriva de la carga parcial positiva del carbono, que no es que se la induzca el oxígeno al carbono, sino que es una carga que nace original con los átomos.
Los enlaces covalentes simples y dobles entre el carbono y el oxígeno, son enlaces covalentes tipo I o enlaces covalentes tipo mixto-mixto, que no alteran la carga eléctrica original de los átomos.
Entonces en esa figura anterior vemos que en el monóxido de carbono la cuestión es distinta, porque el átomo de carbono organiza de forma distinta su octeto de electrones y huecos, por eso después de hacer un par de enlaces covalentes tipo mixto, le restan por un lado un par exclusivo de electrones libres y por el otro lado un par exclusivo de huecos libres, sin embargo al átomo de oxígeno le quedan solo dos pares de exclusivos electrones libres sin huecos.
DIOXIDO DE CARBONO
Describimos a esta molécula de dióxido de carbono para ocuparnos de forma ejemplar en una especie química, donde el átomo de carbono organiza su octeto entre electrones y huecos, lo organiza de forma distinta a como lo hace el mismo carbono en el monóxido de carbono.
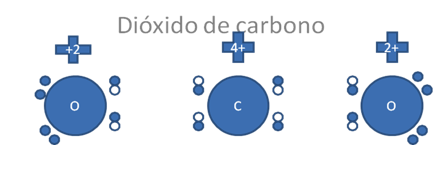
Los pequeños círculos rellenos corresponden a los electrones, los pequeños círculos vacíos corresponden a los huecos.
Figura No.5
Estos dos átomos de oxígeno en la figura anterior, cada uno establece un enlace covalente tipo I o tipo mixto-mixto con el carbono central.
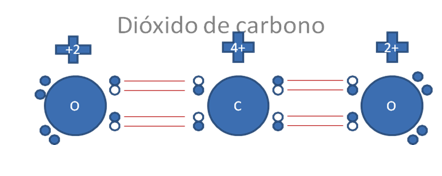
Los pares de barras rojas corresponden cada par a un enlace covalente tipo I o enlace covalente tipo mixto-mixto que no alteran la carga eléctrica de los átomos.
Figura No.6
Los pares de barras rojas corresponden cada par a un enlace covalente tipo I o enlace covalente tipo mixto-mixto que no alteran la carga eléctrica de los átomos.
Figura No.6
El dióxido de carbono es una molécula no polar donde a pesar de que los dos oxígenos tienen carga +2, el carbono central tiene carga +4, apareciendo dos momentos dipolares químicos de sentido contrarios que se anulan.
ENLACE TRIPLE CARBONO-OXÍGENO
En este momento es cuando el átomo de carbono presta a su par de huecos libres para que por intermedio del par de uno de los pares de electrones libres del oxígeno, se configure un enlace covalente coordinado.
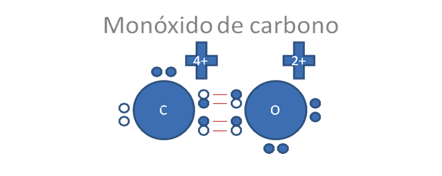
Los círculos pequeños y rellenos son los electrones y los círculos pequeños y vacios corresponden a los huecos, los pares de barras rojas corresponden a un solo enlace covalente tipo mixto-mixto.
Figura No.4
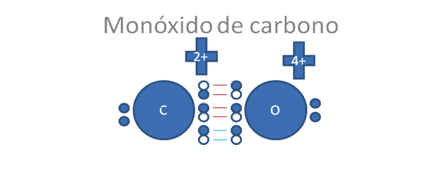
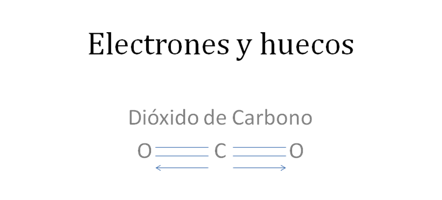
Los círculos pequeños y rellenos son los electrones, los círculos pequeños y vacíos son los huecos, los pares de barras rojas representan a los dos enlaces covalentes mixtos-mitos y las barras de color azul representan al tercer enlace también covalente mixto-mixto pero originado por un enlace coordinado es decir, el par de electrones en el enlace cocinado lo aporta el oxígeno.
Figura No.7
En el enlace coordinado como los dos electrones los aportan el oxigeno, el átomo de oxígeno le entrega al carbono un electrón pero recibe un hueco y por eso se vuelve con carga eléctrica relativa más positiva, mientras el carbono se vuelve con carga eléctrica relativa más negativa.
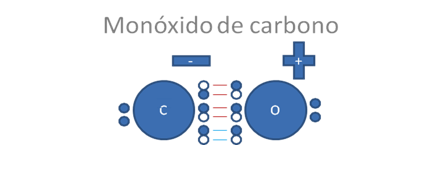
Los círculos pequeños y rellenos son los electrones, los círculos pequeños y vacíos son los huecos, los pares de barras rojas representan a los dos enlaces covalentes mixtos-mitos y las barras de color azul representan al tercer enlace también covalente mixto-mixto pero originado por un enlace coordinado es decir, el par de electrones en el enlace cocinado lo aporta el oxígeno.
Figura No.8

Los círculos pequeños y rellenos son los electrones, las líneas representan a los dos enlaces covalentes tipo mixto-mixto, la flecha indica al tercer enlace de tipo coordinado y la polaridad de la molécula.
Figura No.8
El triple enlace del monóxido de carbono tiene una longitud de 112,8 pm y además es una molécula polarizada de forma invertida, el extremo negativo se ubica en el polo del átomo de carbono y el extremo positivo en el polo del átomo de oxigeno.
EL MONÓXIDO de CARBONO y los IONES DIVALENTES de PLOMO y ESTAÑO
El grupo 14 del carbono y el silicio que está ubicado en el centro de la tabla periódica, configura a 4 pares mixtos de electrones y huecos pero también pueden configurar solo a dos pares mixtos de electrones y huecos.
La segunda opción apareando a dos huecos con dos electrones distintos de los cuatro electrones de valencia, para cumplir con la nueva regla del octeto se formaría así además en el mismo átomo, tanto un par exclusivo de electrones libres y un par exclusivo de huecos libres. Esta configuración acostumbra aparecer hacia abajo del grupo y es típica del germanio el estaño y el plomo incluso, no con todos los aniones porque ocurre con el oxigeno pero no con el azufre.

Los círculos vacios son los huecos, hay cuatro círculos rellenos que son los 4 electrones de valencia de un átomo de plomo.
Figura No.9.
Esto explica los casos de la figura No.10 de los iones divalentes del grupo 14 de la tabla periódica de plomo, germanio y estaño, en los cuales cada uno por su lado sigue cumpliendo a su alrededor en las moléculas que forman la nueva regla del octeto, con dos pares de electrones emplazantes, un par de exclusivos electrones libres y un par de exclusivos huecos libres. La presencia de pares de huecos libres y pares de electrones libres alrededor del octeto del mismo átomo, los facultan para la formación de un triple enlace con doble enlace coordinado como lo hace el carbono.
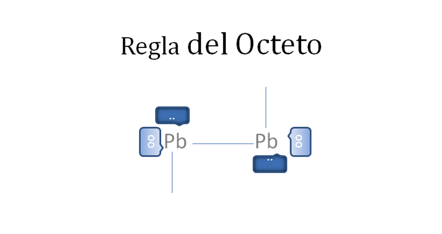
El par de punticos blancos, sólido y rodeado del marco azul oscuro corresponden al par de electrones libres, El par de círculos blancos y vacíos del marco azul claro corresponden al par de huecos electrónicos libres, Las líneas continuas representan enlaces covalentes compartidos tipo I, Pb es el símbolo de un átomo cualquiera del grupo catorce de la tabla periódica.
Figura No.9.
El par de punticos blancos, sólido y rodeado del marco azul oscuro corresponden al par de electrones libres, El par de círculos blancos y vacíos del marco azul claro corresponden al par de huecos electrónicos libres, Las líneas continuas representan enlaces covalentes compartidos tipo I, Pb es el símbolo de un átomo cualquiera del grupo catorce de la tabla periódica.
Figura No.9.
En caso de que cada par de huecos libres electrófilo ubicado en el octeto de cada átomo, sea atacado cada uno por un par de electrones libres nucleó filo ubicado en el octeto de un átomo extraño, se configura un enlace coordinado y quedarían cada átomo solo con los pares nativos de electrones libres y dejaría de ser trans como antes pero quedarían como en la siguiente Figura No.10.
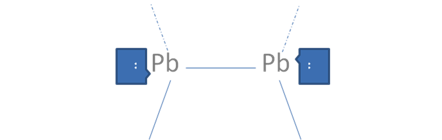
El par de punticos blancos y sólidos en el marco azul oscuro corresponden al par de electrones libres, Las líneas continuas representan enlaces covalentes mixto-mixto, Las líneas por trazos representan a los enlaces covalentes coordinados, Pb es el símbolo de un átomo cualquiera del grupo catorce de la tabla periódica.
Figura No.10
Estos iones divalentes de la figura No.9 si alcanzaran efectuar entre ellos a un solo enlace coordinado, quedarían uno de ellos con un par de electrones libres pero con carga negativa y el otro resultaría, con un par de huecos libres pero con carga positiva tal como lo sugiere la Figura No.11.
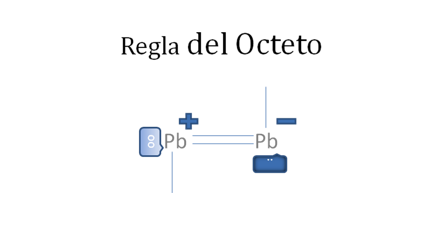
El par de punticos blancos y sólidos en el marco azul oscuro corresponden al par de electrones libres, El par de círculos blancos y vacíos en el marco azul claro corresponden al par de huecos electrónicos libres, Las líneas continuas representan enlaces covalentes, Pb es el símbolo de un átomo cualquiera del grupo catorce de la tabla periódica.
Figura No.11
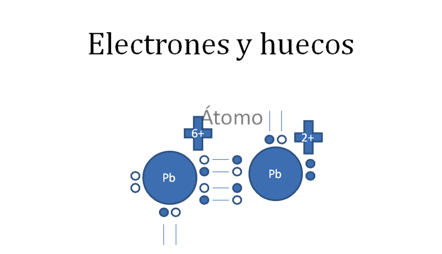
Los círculos vació son los huecos, los círculos pequeños rellenos son los electrones.
Figura No.12
En esta anterior figura No.11 se observa que se puede asumir que el plomo de la derecha, aunque es positivo relativamente es negativo con respecto al átomo de Pb de la izquierda.
En esta anterior figura No.12 se observa que todavía existe la posibilidad de un segundo enlace coordinado que si se lleva a cabo se origina un triple enlace tal como lo ilustra la siguiente figura No.13.
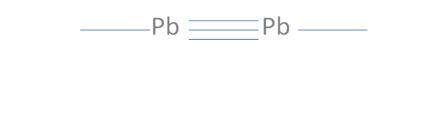
Pb es el símbolo de un átomo cualquiera del grupo catorce de la tabla periódica, Las líneas continuas representan enlaces covalentes.
Figura No.13
ENLACE COORDINADO
El enlace coordinado es un enlace configurado por una base de Lewis y un ácido de Lewis.
La base de Lewis tiene disponibles a un par de partículas apareadas con cargas eléctricas negativas como un par electrones libres.
Pues respectivamente el ácido de Lewis también tiene disponibles a un par de partículas apareadas con cargas eléctricas contrarias como un par de huecos apareados.
Los pares de electrones y huecos hacen un intercambio de partículas, constituyendo pares mixtos que después se aparean con mayor fuerza en un enlace covalente tipo mixto-mixto.
3- Conclusiones:
1- LA PRIMERA Y ÚNICA GRAN CONCLUSIÓN de este artículo es que en realidad, los huecos revolucionan a la fisicoquímica, por las grandes repercusiones que tiene en la carga eléctrica de los átomos en las moléculas. Si bien es cierto que este artículo es solo teoría y que hace falta sobretodo probar en unos semiconductores propuesto en el trabajo de células fotoeléctricas. Además hay fenómenos indiscutibles, como son la identificación de dos tipos de enlaces covalentes en las moléculas hipervalentes, la descripción de los iones divalentes de plomo, etc, etc. Es probable también que el hueco como partícula, explique las anomalías en la configuración electrónica que tienen los elementos de transición.
4- Referencias
REFERENCIAS DEL ARTÍCULO.
[2] Células fotoeléctricas Monografías.
[2] Células Fotoeléctricas textoscientificos.
[3] Semiconductores Monografías.
[4] Semiconductores textoscientificos.
[5] Superconductividad.
[6] Superconductividad.
[7] Alotropía.
[8] Alotropía del Carbono.
[9] Alotropía del Oxigeno.
[10]Ozono.
[11]Diborano
[12]Semiconductores y temperatura.
REFERENCIAS DE LA TEORÍA
[1] Número cuántico magnético.
[2] Ángulo cuántico
[3] Paul Dirac y Nosotros
[4] Numero cuántico Azimutal monografias
[5] Numero cuántico Azimutal textoscientificos
[6] Inflación Cuántica textos científicos.
[7] Números cuánticos textoscientíficos.com.
[8] Inflación Cuántica Monografías
[9] Orbital Atómico
[10] Números Cuánticos.
[11] Átomo de Bohr.
[12] Líneas de Balmer.
[13] Constante Rydberg.
[14] Dilatación gravitacional del tiempo.
[15] Número Cuántico magnético.
[16] Numero Cuántico Azimutal.
Copyright © Derechos Reservados.
Heber Gabriel Pico Jiménez MD. Médico Cirujano 1985 de la Universidad de Cartagena Colombia. Investigador independiente de problemas biofísicos médicos propios de la memoria, el aprendizaje y otros entre ellos la enfermedad de Alzheimer.
Estos trabajos, que lo más probable es que estén desfasados por la poderosa magia secreta que tiene la ignorancia y la ingenuidad, sin embargo, como cualquier representante de la comunidad académica que soy, también han sido debidamente presentados sobretodo este se presentó el 30 de Junio del 2013 en la “Academia Colombiana de Ciencias Exactas, Físicas y Naturales” ACCEFYN.