Relaciones generales entre las capacidades caloríficas
Sabemos que el volumen es función de dos variables termodinámicas que pueden ser P y T es decir:
V = f(P,T)
Se cumplirá entonces que:
![]()
Reemplazando este valor de dV en la ecuación (3):
![]()
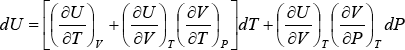 (14)
(14)
Haciendo U = f(P,T)
![]() (15)
(15)
Como los coeficientes de dT y dP en las ecuaciones (14) y (15) deben ser idénticos, se deduce que:
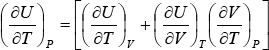
Despejando ![]() y reemplazando por su valor dado por (1)
y reemplazando por su valor dado por (1)
![]() (16)
(16)
De las ecuaciones (2) y (8) :
![]() (17)
(17)
Restando la ecuación (16) de la (17), resulta:
![]() (18)
(18)
Esta ecuación que relaciona las capacidades caloríficas a presión y volumen constante, es aplicable a cualquier sistema homogéneo de composición constante. Se puede simplificar cuando se conoce la ecuación de estado del sistema o sea la relación matemática entre P,V y T. El caso más sencillo es el de los gases ideales. Como dijimos que para un gas ideal se cumple la ecuación (4), aplicándola en la ecuación (18) se obtiene:
![]() (19)
(19)
Para un mol de gas ideal, la ecuación de estado será:
P.V = R . T
Derivando con respecto a T a P constante:
![]()
Reemplazando en (19), resulta:
CP – CV = R (20)
Esta ecuación se denomina Ecuación de Mayer. Las capacidades caloríficas CP y CV son molares pues hemos considerado un mol de gas;
En los gases reales CP - CV no es exactamente igual a R, pero sus valores no se alejan tanto, salvo en condiciones donde las desviaciones del comportamiento ideal son muy grandes, por ejemplo a presiones elevadas y temperaturas bajas.