Cuando un sistema está rodeado por una pared adiabática es posible realizar trabajo sobre él, o bien que el sistema entregue trabajo, sin embargo no puede haber intercambio de calor entre el sistema y el medio ambiente.
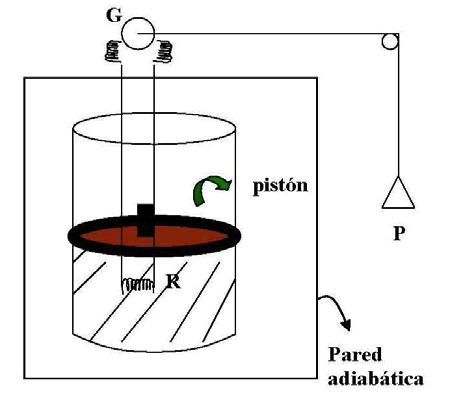
Tomemos como ejemplo el recipiente con agua dentro del cual se coloca una resistencia, por la cual circula corriente eléctrica suministrada desde un generador movido por unas pesas que caen.
En este caso, el recipiente está rodeado completamente con una cubierta adiabática que impide el intercambio de calor entre el sistema, formado por la resistencia y el agua, y el medio exterior que contiene las pesas.
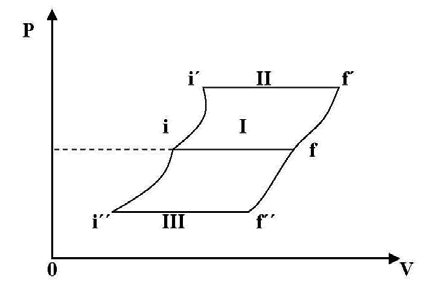
Como se comprueba experimentalmente, es posible hacer pasar el sistema del estado inicial al estado final realizando sobre él únicamente trabajo, que en estas condiciones recibe el nombre particular de “trabajo adiabático”. Podemos representar en un diagrama P-V la transformación seguida por el sistema cuando manteniendo la presión constante, se hace pasar la corriente por la resistencia. El sistema pasará del estado inicial i al final f por la trayectoria I. Esta trayectoria no es la única por la cual el sistema puede pasar de i a f, realizando sobre él únicamente trabajo adiabático. Por medio de un pistón podríamos comprimir de i hasta i´ en condiciones adiabáticas, luego hacer circular corriente por la resistencia para pasar de i´a f´ y por último dejar expandir el agua adiabáticamente hasta alcanzar el estado f. (trayectoria II).
En igual forma podría utilizarse la trayectoria III. Existen infinitas trayectorias por las que se podría llevar el sistema de i a f suministrándole trabajo adiabático. Los resultados experimentales indican que en todas estas trayectorias el trabajo adiabático suministrado es el mismo. Este hecho puede enunciarse como una forma del Primer Principio de la Termodinámica diciendo que si un sistema se hace pasar de un estado inicial a otro final mediante procesos adiabáticos únicamente, el trabajo realizado será el mismo cualquiera sea la trayectoria adiabática que una dichos estados.
Como el trabajo adiabático es una magnitud cuyo valor depende únicamente de los estados inicial y final de la transformación y no de la trayectoria, de acuerdo con lo dicho antes, será una función de estado del sistema, por consiguiente, existirá una función de las variables de estado de un sistema termodinámico, cuyo valor en el estado finalmenos su valor en el estado inicial sea igual al trabajo adiabático realizado para pasar el sistema de un estado a otro. Esta función que simbolizaremos con la letra U se denomina energía interna. Matemáticamente se puede escribir:
−Wi→f(ad) = Uf− Ui = ΔU (4)
El signo menos correspondiente al trabajo adiabático, se debe a que en este caso ha sido realizado sobre el sistema.