Según vimos salvo el fluoruro, NF3, los restantes halogenuros de nitrógeno tienen poca importancia debido a su inestabilidad. Sin embargo la química de los halogenuros de fósforo es mucho más relevante por ser éstos productos de partida para una gran cantidad de compuestos.
Los halogenuros de P más importantes son PX3 (P(III)) y PX5 (P(V)). Son compuestos covalentes con enlaces poco polares (la diferencia de electronegatividad entre P y X es escasa).
También se conocen los compuestos P2X4 y por supuesto los haluros mixtos, aunque son de menos importancia.
Haluros de P(V)
En estado vapor los pentahaluros PF5, PCl5, AsF5, SbCl5 poseen estructura de bipirámide trigonal.
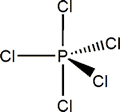
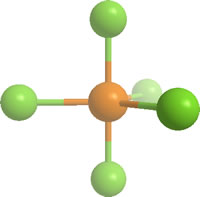
PF5 tiene una estructura molecular de bipirámide trigonal. Se ha determinado que la distancia P-F para los F axiales es de 1.58Å y para los F ecuatoriales 1.53Å. Sin embargo la molécula es fluxional, no rígida, y como resultado los cinco átomos de P se hacen equivalentes (no discernibles por técnicas como RMN).
Es una sustancia gaseosa, reactiva y que se hidroliza inmediatamente en agua. Es un ácido de Lewis fuerte y tiene una gran tendencia a aceptar otro F- para formar la especie PF6-.
PCl5 es un compuesto molecular en fase gas, con la misma estructura que PF5, pero en sólido (de color blanco) la estructura está a medio camino entre iónica y covalente con presencia de dos entidades iónicas complejas, una con estructura octaédrica y otra con estructura tetraédrica: [PCl6]-[PCl4]+.
En disolución la estructura puede ser iónica o molecular dependiendo del disolvente.
Se obtiene por reacción directa de cloro con el fósforo: P4 (s) + 10 Cl2 (g) ![]() 4 PCl5.
4 PCl5.
Se descompone si se le calienta según: PCl5 ![]() PCl3 + Cl2
PCl3 + Cl2
o por el agua en una reacción en dos etapas:
PCl5 + H2O
![]() POCl3 + 2 HCl (R. Rápida)
POCl3 + 2 HCl (R. Rápida)
POCl3 + 3
H2O ![]() OP(OH)3 (ácido fosfórico) + 3HCl (R. Lenta)
OP(OH)3 (ácido fosfórico) + 3HCl (R. Lenta)
R. total: PCl5 (s) + 4 H2O
(l) ![]() H3PO4 (ac) + 5 H+(ac) + 5 Cl- (ac)
H3PO4 (ac) + 5 H+(ac) + 5 Cl- (ac)
El pentacloruro de P se obtiene a escala industrial (20.000-30.000 tn/año). Constituye la materia prima para la obtención de multitud de compuestos orgánicos e inorgánicos de fósforo.
Los pentacloruros de As y Sb se hidrolizan según una reacción análoga para dar:
AsCl5 + 4
H2O ![]() H3AsO4 + 5H++
5Cl-
H3AsO4 + 5H++
5Cl-
SbCl5 + 4 H2O ![]() H3SbO4 + 5H++ 5Cl-
H3SbO4 + 5H++ 5Cl-
El resto de los pentahaluros de fósforo, como el PBr5 también se ioniza pero originando especies con índice de coordinación más bajo [PBr4]-Br+. Este hecho puede interpretarse debido a la mayor dificultad para alojar cinco o seis átomos de bromo o iodo alrededor del átomo de fósforo, por el gran tamaño del halógeno.
Haluros de P(III)
En estado gaseoso todos ellos están constituidos por moléculas con estructura de pirámide trigonal: puede considerarse el empleo de orbitales híbridos sp3 no equivalentes. Conforme el halógeno aumenta de tamaño, también lo hace el ángulo (mayor separación significa menor repulsión). Sin embargo este argumento, por sí sólo, no justifica la tendencia a abrir el ángulo puesto que también aumenta la distancia de enlace P-X contrarrestando el efecto del aumento del radio de van der Waals. El argumento adicional lo debemos buscar en el descenso de electronegatividad. El F atrae sobre sí el par de electrones de enlace permitiendo al p.s. expandirse con mayor facilidad cerrando el ángulo de enlace.
Ángulos de enlace
PX3 |
ECl3 |
||
|---|---|---|---|
F-P-F |
97.8º |
Cl-P-Cl |
100.3º |
Cl-P-Cl |
100.3º |
Cl-As-Cl |
98.7º |
Br-P-Br |
101º |
Cl-Sb-Cl |
99.5º |
I-P-I |
102º |
||
Obtención
Los trihaluros se obtienen por reacciones de síntesis directa, salvo el PF3 que se obtiene por intercambio de halógeno. Al ser el F2 tan oxidante la reacción directa conduce al PF5.
PCl3(l) +
AsF3 (l) ![]() PF3 (g) + AsCl3 (l)
PF3 (g) + AsCl3 (l)
La fuerza impulsora de esta reacción es la mayor fuerza del enlace fósforo-flúor en comparación con las otras energías de enlace (P–F: 490 kJ/mol; As–F: 406; P–Cl: 326; As–Cl: 322).
Reactividad
PF3 y NF3 difieren a la hora de formar compuestos de coordinación. Así, mientras el NF3 carece de capacidad para actuar como ligando, el PF3 forma complejos como el Ni(PF3)4 o Cr(PF3)6 y otros. Al igual que el CO, el PF3 es un débil dador s y aceptor p, posibilitado por la existencia de orbitales d, no ocupados.
El más importante comercialmente de los trihaluros es el PCl3. Se utiliza para preparar una amplia variedad de productos que incluyen jabones, detergentes plásticos e insecticidas. Es un líquido incoloro (P.f. 76ºC) que se presenta en todas las fases como un compuesto covalente.
Se obtiene haciendo pasar una corriente de cloro gaseoso seco sobre fósforo blanco o rojo.
Si se tiene un exceso de cloro puede formarse el pentacloruro. Se pueden observar varios tipos de reacciones en tricloruro de fósforo.
- PCl3 + H2O
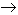 PO3H3
PO3H3 - PCl3 + ROH
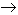 P(OR)3
P(OR)3 - PCl3 + R2NH
 P(NR2)3
P(NR2)3 - PCl3 + RMgBr
 PR3+ Ni(CO)4
PR3+ Ni(CO)4 Ni(CO)3PR3
Ni(CO)3PR3 - PCl3 + AsF3
 PF3
PF3 - PCl3 + IH
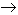 PI3
PI3 - PCl3 + O2
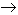 OPCl3
OPCl3 - PCl3 + S8
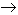 SPCl3
SPCl3 - PCl3 + Cl2
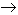 PCl5
PCl5
Reacción de oxidación con el oxígeno atmosférico
A temperatura ambiente para dar el oxohaluro POX3. La velocidad de reacción es lenta en el aire. Los pentahaluros no pueden oxidarse de igual manera puesto que ya están en su estado de oxidación máximo.
2 PCl3 (l)
+ O2 (g) ![]() 2 POCl3 (l) (oxicloruro de fósforo)
2 POCl3 (l) (oxicloruro de fósforo)
De cualquier manera, el oxicloruro de fósforo en ambientes húmedos evoluciona hasta el ácido fosforoso, al igual que los cloruros de fósforo:
POCl3 (l)
+ 3 H2O ![]() 2 H3PO3 (ac) + 3 HCl (ac)
2 H3PO3 (ac) + 3 HCl (ac)
Reacciones de hidrólisis o solvólisis.
Como les ocurre a los pentahaluros, los trihaluros se hidrolizan con agua para dar el oxoácido y el halogenuro de hidrógeno correspondientes. En general la hidrólisis de los pentahaluros es más intensa que en los trihaluros.
PF3 + 3 H2O
![]() H3PO3 (ácido fosforoso) + 3 HF
H3PO3 (ácido fosforoso) + 3 HF
PCl3 + 3 H2O
![]() H3PO3 (ácido fosforoso) + 3 HCl
H3PO3 (ácido fosforoso) + 3 HCl
Tratándose de halogenuros covalentes sufren reacciones de hidrólisis y de solvólisis (reacción con otros disolventes próticos). A diferencia del fluoruro, el cloruro se hidroliza con rapidez. La hidrólisis es muy escasa para PF3 debido a la robustez del enlace P-F.
El ataque nucleofílico se da sobre el P, ya que este posee orbitales d vacíos.
La hidrólisis del NCl3 da lugar a otros productos de reacción, justamente debido a que el ataque nucleofílico esta vez se da sobre los átomos de Cl, que si que poseen orbitales d)
NCl3 + 3 H2O
![]() NH3 + 3 HClO
NH3 + 3 HClO
Reacciones de intercambio de halógeno.
Los trihaluros pueden intercambiar el halógeno por el grupo alquilo o arilo, dando lugar a las alquil o aril fosfinas cuando reacciona con los organomagnesianos. Estas fosfinas pueden actuar como bases de Lewis en compuestos de coordinación. Son bases blandas con un enlace sinérgico s y p. El P cede un par de electrones al metal utilizando un orbital s y el metal retrodona densidad electrónica a un orbital p vacío del P. Las fosfinas se combinan preferentemente con ácidos blandos, metales en estados de oxidación bajos (<4).